Différence entre les propriétés colligatives des électrolytes et des non électrolytes
Différence clé - Colligative Propriétés des électrolytes vs non électrolytes
Les propriétés colligatives sont les propriétés physiques d'une solution qui dépend de la quantité de soluté mais pas de la nature du soluté. Cela signifie que des quantités similaires de solutés complètement différents peuvent modifier ces propriétés physiques en quantités similaires. Par conséquent, les propriétés colligatives dépendent du rapport de la quantité de soluté et de la quantité de solvant. Les trois principales propriétés colligatives sont la baisse de la pression de vapeur, l'élévation du point d'ébullition et la dépression du point de congélation. Pour un rapport de masse de soluté-solvant donné, toutes les propriétés colligatives sont inversement proportionnelles à la masse molaire du soluté. Les électrolytes sont des substances qui peuvent former des solutions capables de conduire de l'électricité grâce à cette solution. Ces solutions sont appelées solutions électrolytiques. Les non électrolytes sont des substances qui ne sont pas capables de former des solutions électrolytiques. Ces deux types (électrolytes et non électrolytes) ont des propriétés colligatives. Le différence clé entre les propriétés colligatives des électrolytes et des non électrolytes est que L'effet des électrolytes sur les propriétés colligatifs est très élevée par rapport à celle des non électrolytes.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les propriétés colligatives des électrolytes
3. Quelles sont les propriétés colligatives des non électrolytes
4. Comparaison côte à côte - propriétés colligatives des électrolytes vs non électrolytes sous forme tabulaire
5. Résumé
Quelles sont les propriétés colligatives des électrolytes?
Les propriétés colligatives des électrolytes sont les propriétés physiques des solutions électrolytiques qui dépendent de la quantité de solutés, quelle que soit la nature des solutés. Les solutés présents dans les solutions électrolytiques sont des atomes, des molécules ou des ions ayant perdu ou gagné des électrons pour devenir électriquement conducteur.
Lorsqu'un électrolyte est dissous dans un solvant comme l'eau, l'électrolyte se sépare en ions (ou toute autre espèce conductrice). Par conséquent, la dissolution d'une mole d'électrolyte donne toujours deux moles ou plus d'espèces conductrices. Par conséquent, les propriétés colligatives des électrolytes changent considérablement lorsqu'un électrolyte est dissous dans un solvant.
Par exemple, l'équation générale utilisée pour décrire les changements de point de congélation et de point d'ébullition est le suivant,
Δtb = Kbm et ΔtF = KFm
Δtb est l'élévation du point d'ébullition, et ΔtF La dépression de point de congélation est-elle. Kb et kF sont constamment une élévation du point d'ébullition et une constante de dépression de point de congélation respectivement. M est la molarité de la solution. Pour les solutions électrolytiques, les équations ci-dessus sont modifiées comme suit,
Δtb = ikbm et ΔtF = ikFm
«I» est un multiplicateur ion connu sous le nom de Van't Hoff Factor. Ce facteur est égal au nombre de moles d'ions donnés par un électrolyte. Par conséquent, le facteur Van't Hoff peut être déterminé en trouvant le nombre d'ions libérés par un électrolyte lorsqu'il est dissous dans un solvant. Par exemple, la valeur du facteur Van't Hoff pour NaCl est de 2 et en cacl2, c'est 3.

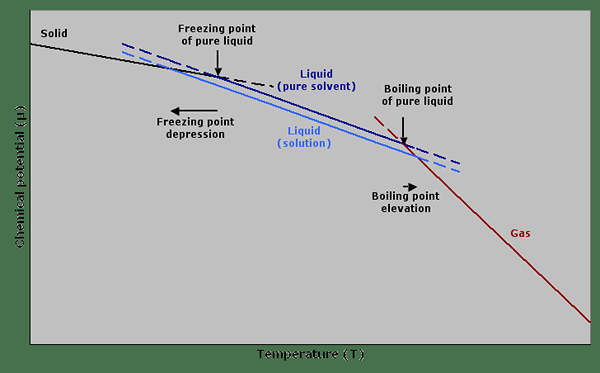
Figure 01: Un graphique montrant le potentiel chimique contre la température décrivant la dépression de point de congélation et l'élévation du point d'ébullition
Cependant, les valeurs données pour ces propriétés colligatives sont différentes des valeurs théoriquement prédites. C'est parce qu'il peut y avoir des interactions de soluté et de solvant qui réduisent l'effet des ions sur ces propriétés.
Les équations ci-dessus sont encore modifiées pour être utilisées pour les électrolytes faibles. Les électrolytes faibles se dissocient partiellement en ions, donc certains des ions n'affectent pas les propriétés colligatives. Le degré de dissociation (α) d'un électrolyte faible peut être calculé comme suit,
α = (i-1) / (n-1) x 100
Ici, n est le nombre maximum d'ions formé par molécule de l'électrolyte faible.
Quelles sont les propriétés colligatives des non électrolytes?
Les propriétés colligatives des non électrolytes sont les propriétés physiques des solutions non électrolytiques qui dépendent de la quantité de solutés quelle que soit la nature des solutés. Les non-électrolytes sont des substances qui ne créent pas de solutions conductrices lorsqu'ils sont dissous dans un solvant. Par exemple, le sucre est un non électrolyte car lorsque le sucre est dissous dans l'eau, il existe sous forme moléculaire (ne se dissocie pas en ions). Ces molécules de sucre sont incapables de mener des courants électriques à travers la solution.
Le nombre de solutés présents dans une solution non électrolytique est inférieure à une solution électrolytique. Par conséquent, l'effet des non électrolytes sur les propriétés colligatifs est également très faible. Par exemple, le degré de baisse de la pression de vapeur en ajoutant du NaCl est plus élevé par rapport à l'ajout de sucre à une solution similaire.
Quelle est la différence entre les propriétés colligatives des électrolytes et des non électrolytes?
Propriétés colligatives des électrolytes vs non électrolytes | |
| Les propriétés colligatives des électrolytes sont les propriétés physiques des solutions électrolytiques qui dépendent de la quantité de solutés, quelle que soit la nature des solutés. | Les propriétés colligatives des non électrolytes sont les propriétés physiques des solutions non électrolytiques qui dépendent de la quantité de solutés quelle que soit la nature des solutés. |
| Solutés | |
| Les électrolytes fournissent plus de solutés à la solution via la dissociation; Par conséquent, les propriétés colligatives sont considérablement modifiées. | Les non électrolytes fournissent un faible soluté à la solution car il n'y a pas de dissociation; Par conséquent, les propriétés colligatives ne sont pas considérablement modifiées. |
| Effet sur les propriétés colligatives | |
| L'effet des électrolytes sur les propriétés colligatifs est très élevée par rapport aux non électrolytes. | L'effet des non électrolytes sur les propriétés colligatifs est très faible par rapport aux électrolytes. |
Résumé - Colligative Propriétés des électrolytes vs non électrolytes
Les propriétés colligatives sont les propriétés physiques des solutions qui ne dépendent pas de la nature d'un soluté mais de la quantité de solutés. La différence entre les propriétés colligatives des électrolytes et des non électrolytes est que l'effet des électrolytes sur les propriétés colligatifs est très élevée par rapport aux non électrolytes.
Référence:
1.«5.9: Propriétés colligatives des solutions d'électrolyte.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
2.«Propriétés colligatives.»Wikipedia, Wikimedia Foundation, 10 mars. 2018. Disponible ici
3.Britannica, les éditeurs de l'Encyclopaedia. "Électrolyte.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 juin 2017. Disponible ici
Image gracieuseté:
1.«Point de congélation dépression et élévation du point d'ébullition» par Tomas Er - propre travail, (CC By-sa 3.0) via Commons Wikimedia


