Différence entre le chloroforme et le tétrachlorure de carbone
Le différence clé entre le chloroforme et le tétrachlorure de carbone est que le chloroforme (chcl3) est une puissante anesthésie, mais du tétrachlorure de carbone (CCL4) n'est pas un anesthésique.
De plus, le chloroforme et le tétrachlorure de carbone ont la même géométrie chimique; géométrie tétraédrique. Étant donné que la structure chimique et la composition du tétrachlorure de carbone ressemblent au chloroforme, la plupart des gens comprennent mal penser que les deux sont les mêmes. Cependant, le tétrachlorure de carbone n'a que des atomes de carbone et de chlore tandis que le chloroforme a des atomes de carbone, de chlore et d'hydrogène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chloroforme
3. Qu'est-ce que le tétrachlorure de carbone
4. Comparaison côte à côte - chloroforme vs tétrachlorure de carbone sous forme tabulaire
5. Résumé
Qu'est-ce que le chloroforme?
Le chloroforme est chcl3 , qui est utilisé comme un puissant anesthésie. Le nom IUPAC de ce composé est le trichlorométhane. C'est un liquide incolore et dense qui a une odeur douce. Le but de la production à grande échelle de ce composé est un précurseur pour produire PTFE. La majeure partie du chloroforme dans l'environnement (environ 90%) est due aux émissions d'origine naturelle. Ex: De nombreux types d'algues et de champignons produisent ce composé.
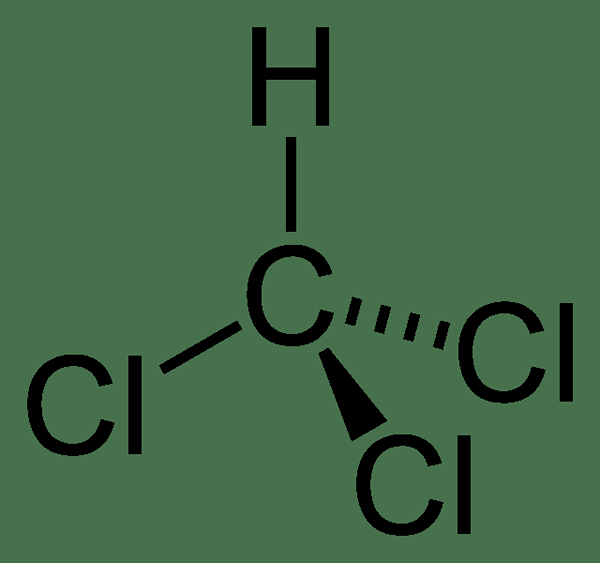
La masse molaire du composé est 119.37 g / mol, et il apparaît comme un liquide incolore à température ambiante. Il a une forte odeur éthérée. Le point de fusion est −63.5 ° C, et le point d'ébullition est 61.15 ° C. De plus, il se décompose à 450 ° C. La molécule de chloroforme a une géométrie tétraédrique.

Figure 01: Structure chimique du chloroforme
À l'échelle industrielle, nous pouvons produire ce composé via le chauffage d'un mélange de chlore et de chlorométhane (ou parfois nous utilisons également du méthane). Lors du chauffage, une halogénation des radicaux libres se produit à 400-500 ° C. Là, les composés chlorés du chlorométhane (ou méthane) se forment qui donnent du chloroforme. Là, ce composé peut subir une chloration supplémentaire, formant du tétrachlorure de carbone. Cependant, le produit final de cette réaction est un mélange de chlorométhanes que nous pouvons séparer via la distillation afin d'obtenir du chloroforme.
Il existe de nombreuses utilisations de chloroforme. Il est utile comme solvant car l'atome d'hydrogène dans cette molécule peut subir une liaison hydrogène. Nous pouvons également l'utiliser comme réactif pour de nombreuses réactions chimiques. Ex: comme source de groupe de dichlorocarbène. Plus important encore, le chloroforme est bien connu pour ses propriétés anesthésiques.
Qu'est-ce que le tétrachlorure de carbone?
Le tétrachlorure de carbone est CCL4 , que nous appelons généralement le «tétrachlorométhane». C'est un liquide incolore ayant une odeur douce. Nous pouvons le détecter de son odeur même à bas niveau. Dans l'industrie du nettoyage, le nom commun de ce composé est le carbone TET.
La masse molaire est de 153.81 g / mol. Le point de fusion est −22.92 ° C, et le point d'ébullition est 76.72 ° C. La géométrie de cette molécule est la géométrie tétraédrique. Puisqu'il a quatre atomes de chlore liés à un seul atome de carbone, les angles de liaison des molécules sont égaux. Nous l'appelons une «géométrie symétrique». En raison de cette géométrie, le composé est non polaire. Il ressemble à la structure de la molécule de méthane qui a quatre atomes d'hydrogène liés à un seul atome de carbone.
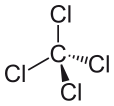
Figure 02: Structure chimique du tétrachlorure de carbone
Il existe de nombreuses utilisations de tétrachlorure de carbone. Avant l'interdiction, ce composé a été utilisé pour produire CFC à grande échelle. De nos jours, nous ne produisons pas de CFC car il nuit à la couche d'ozone. Le tétrachlorure de carbone est l'ingrédient clé des lampes de lave. Une fois qu'il s'agissait d'un solvant populaire, mais maintenant nous ne l'utilisons pas en raison de ses effets néfastes sur la santé. De plus, nous l'utilisons largement dans les extincteurs, comme précurseur des réfrigérants et comme agent de nettoyage.
Quelle est la différence entre le chloroforme et le tétrachlorure de carbone?
Le chloroforme est chcl3 et est utile comme un puissant anesthésie. Le tétrachlorure de carbone est CCL4, que nous appelons généralement le «tétrachlorométhane» n'est pas un anesthésie. C'est la principale différence entre le chloroforme et le tétrachlorure de carbone. De plus, selon la structure moléculaire, le chloroforme a cinq atomes; un atome de carbone, un atome d'hydrogène et trois atomes de chlore, et la géométrie moléculaire est une géométrie asymétrique tétraédrique. Mais, bien que le tétrachlorure de carbone ait également cinq atomes, il a un atomes de carbone et quatre atomes de chlore, et la géométrie moléculaire est une géométrie symétrique tétraédrique. De plus, compte tenu de leurs propriétés, la masse molaire du chloroforme est de 119.37 g / mol. Il apparaît comme un liquide incolore dense et a une forte odeur éthérée. Tandis que la masse molaire de tétrachlorure de carbone est de 153.81 g / mol. Il apparaît comme un liquide incolore et a une odeur douce. L'infographie ci-dessous présente plus de détails sur la différence entre le chloroforme et le tétrachlorure de carbone sous forme tabulaire.
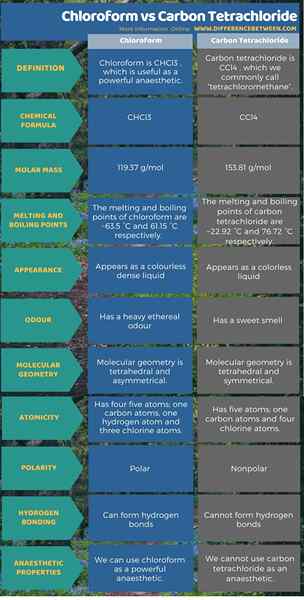
Résumé - chloroforme vs tétrachlorure de carbone
Étant donné que le chloroforme et le tétrachlorure de carbone ressemblent à leur structure chimique et à leur composition, la plupart des gens leur méconnaissent être le même composé. Mais, le tétrachlorure de carbone n'a que des atomes de carbone et de chlore tandis que le chloroforme a des atomes de carbone, de chlore et d'hydrogène. De plus, la principale différence entre le chloroforme et le tétrachlorure de carbone est que nous pouvons utiliser le chloroforme comme un puissant anesthésie, mais nous ne pouvons pas utiliser le tétrachlorure de carbone comme anesthésique.
Référence:
1. "Chloroforme.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
2. "Le tétrachlorure de carbone.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.«Chloroform affiché» par Benjah-Bmm27, vectorisé par fvasconcellos (domaine public) via Commons Wikimedia
2.«Tetrachlorthan» par Neurotiker (Talk) - Propre travaux, (domaine public) via Commons Wikimedia


