Différence entre le chlore et le chloramine

Le différence clé entre le chlore et le chloramine est que Le chlore est un composé gazeux composé de deux atomes de chlore par molécule tandis que le chloramine est une classe de composés gazeux constitués de molécules d'ammoniac avec des substitutions de chlore.
Le chlore gazeux a le formule chimique CL2. La formule chimique de la chloramine varie selon la substitution du chlore; Un, deux ou les trois atomes d'hydrogène de l'ammoniac peuvent être substitués par des atomes de chlore.

CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlore
3. Qu'est-ce que la chloramine
4. Comparaison côte à côte - chlore vs chloramine sous forme tabulaire
5. Résumé
Qu'est-ce que le chlore?
Le chlore est un composé gazeux qui a une couleur jaune-vert et une odeur irritante. En termes chimiques, il fait référence à l'élément chimique qui a le numéro atomique 17. Il fait partie des halogènes du tableau périodique des éléments (les éléments du groupe 7 sont appelés halogènes). Mais en termes généraux, le terme chlore fait référence au chlore gazeux.
Le chlore gazeux est un agent oxydant fort. La masse molaire de ce gaz est de 70 g / mol et la formule chimique est Cl2. Par conséquent, c'est un gaz diatomique. Ce gaz est couramment utilisé comme désinfectant et agent de nettoyage. Et aussi, c'est un puissant irritant pour les yeux et les poumons. L'inhalation du chlore gaz. Ce gaz est légèrement soluble dans l'eau et le gaz peut être facilement liquéfié en appliquant une pression (à température ambiante).

Figure 01: chlore gazeux dans une bouteille
Le chlore gazeux n'est pas inflammable mais il peut soutenir la combustion (comme l'oxygène gazeux). La vapeur de ce gaz est plus lourde que l'air normal. Par conséquent, si ce gaz est dans un récipient avec de l'air normal, il reste dans la partie inférieure du récipient (coule au fond car il est relativement lourd). Le chlore gazeux peut être utilisé pour purifier l'eau dans les piscines et le spa. De plus, il peut blanchir la pulpe de bois. De plus, ce gaz est utilisé pour fabriquer d'autres produits chimiques contenant du chlore.
Qu'est-ce que la chloramine?
La chloramine est un composé gazeux ayant le formule chimique NH2CL. Ce composé appartient à une classe de composés qui a un, deux ou les trois atomes d'hydrogène d'une molécule d'ammoniac substitués par des atomes de chlore (monochloramine chloramine, NH2Cl, dichloramine nhcl2, et trichlorure d'azote ncl3). Là, le terme monochloramine fait référence au terme général «chloramine».
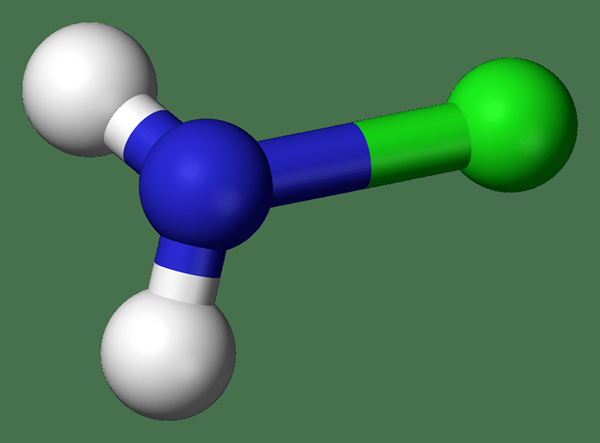
Figure 02: Structure de chloramine (bleu - azote, hydrogène blanc, vert - chlore)
La masse molaire de ce gaz est 51.47 g / mol. C'est un gaz incolore. Le point de fusion de la chloramine est de −66 ° Cat qui, ce gaz se transforme en un état liquide instable. Cependant, la manipulation de ce composé est comme une solution aqueuse diluée; Par conséquent, parfois il peut agir comme un désinfectant. Étant donné que l'état liquide est très instable, il est difficile de mesurer le point d'ébullition de la chloramine. Il est utile dans la désinfection de l'eau. De plus, il est favorable que le chlore gazeux car il est moins agressif et plus stable contre la lumière.
Quelle est la différence entre le chlore et le chloramine?
Chlore vs chloramine | |
| Le chlore est un composé gazeux ayant une couleur jaune-vert et une odeur irritante. | La chloramine est un composé gazeux ayant la formule chimique NH2CL. |
| Couleur | |
| Le gaz a une couleur jaune verdâtre. | C'est un gaz incolore. |
| Formule chimique | |
| CL2 | NH2CL |
| Masse molaire | |
| 70 g / mol | 51.47 g / mol |
| Toxicité | |
| Un gaz toxique | Relativement moins toxique |
Résumé - chlore vs chloramine
Le chlore et le chloramine sont des gaz qui ont essentiellement des atomes de chlore dans leur structure chimique. La différence entre le chlore et le chloramine est que le chlore est un composé gazeux composé de deux atomes de chlore par molécule tandis que le chloramine est une classe de composés gazeux constitués de molécules d'ammoniac avec des substitutions de chlore.
Référence:
1. «Chlore - Informations sur les éléments, propriétés et utilisations | Tableau périodique.»Royal Society of Chemistry - Faire progresser l'excellence dans les sciences chimiques. Disponible ici
2. "Chlore.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
3. «Chloramine.»Wikipedia, Wikimedia Foundation, 10 mai 2018. Disponible ici
Image gracieuseté:
1.'Chlore en bouteille' par w. Oelen (CC BY-SA 3.0) via Commons Wikimedia
2.'Chloramine-3D-Balls' par Jynto et Ben Mills (domaine public) via Commons Wikimedia


