Différence entre l'équilibre chimique et l'équilibre dynamique
Le différence clé entre l'équilibre chimique et l'équilibre dynamique est que le L'équilibre chimique décrit l'état à laquelle les concentrations de réactifs et de produits ne subissent aucun changement tandis que l'équilibre dynamique décrit l'état à quel rapport réactif et produits ne changent pas, mais les substances se déplacent entre les produits chimiques à un rythme égal.
Lorsqu'un ou plusieurs réactifs sont convertis en produits, ils peuvent passer par différentes modifications et changements d'énergie. Les liaisons chimiques dans les réactifs se brisent et de nouvelles liaisons se forment pour générer des produits, qui sont totalement différents des réactifs. Nous nommons ce type de modification chimique en tant que réaction chimique. La thermodynamique est l'étude des transformations de l'énergie qui concerne l'énergie et la position de l'équilibre dans une réaction.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'équilibre chimique
3. Qu'est-ce que l'équilibre dynamique
4. Comparaison côte à côte - Équilibre chimique vs équilibre dynamique dans la forme tabulaire
6. Résumé
Qu'est-ce que l'équilibre chimique?
L'équilibre chimique est l'état dans lequel les réactifs et les produits sont présents à des concentrations qui n'ont plus tendance à changer avec le temps. Certaines réactions sont réversibles et certaines réactions sont irréversibles. En réaction, les réactifs se convertissent en produits. Et dans certaines réactions, les réactifs génèrent à nouveau à partir des produits. Par conséquent, ce type de réaction est réversible.
Dans des réactions irréversibles, une fois que les réactifs sont convertis en produits, ils ne se régénèrent pas à partir des produits. Dans une réaction réversible lorsque les réactifs vont aux produits, nous l'appelons la réaction avant, et lorsque les produits vont réactifs, c'est la réaction vers l'arrière.

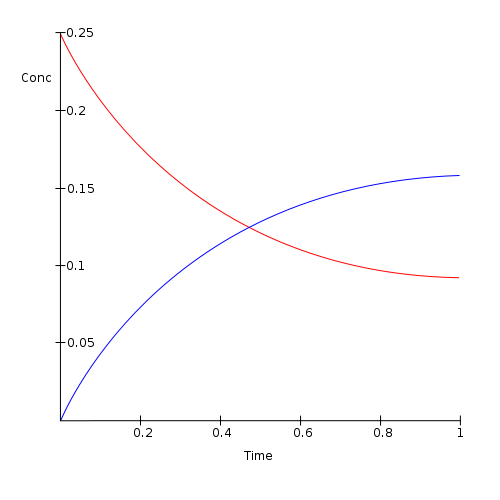
Figure 01: La quantité de réactifs (en rouge) diminuait et la quantité de produits (en bleu) augmente après l'équilibre chimique
Nature de la réaction
Lorsque la vitesse des réactions vers l'avant et vers l'arrière est égale, alors la réaction est à l'équilibre. Par conséquent, pendant un certain temps, la quantité de réactifs et de produits ne changent pas. Les réactions réversibles ont toujours tendance à venir à l'équilibre et à maintenir cet équilibre. Lorsque le système est à l'équilibre, la quantité de produits et les réactifs ne sont pas nécessairement égaux. Il peut y avoir une quantité plus élevée de réactifs que les produits ou vice versa. La seule exigence dans une équation d'équilibre est de maintenir une quantité constante des deux dans le temps. Pour une réaction en équilibre, nous pouvons définir une constante d'équilibre; où il est égal au rapport entre la concentration de produits et la concentration de réactions.
K = [produit]n/[réactif]m
Où, n et m sont les coefficients stœchiométriques du produit et du réactif. Pour une réaction d'équilibre, si la réaction avant est exothermique, alors la réaction vers l'arrière est endothermique et vice versa. Normalement, tous les autres paramètres pour les réactions avant et arrière sont opposées aux autres comme celle-ci. Par conséquent, si nous voulons faciliter l'une ou l'autre des réactions, nous devons simplement ajuster les paramètres pour faciliter cette réaction.
Qu'est-ce que l'équilibre dynamique?
L'équilibre dynamique est également un type d'équilibre où les quantités de produits et de réactifs ne changent pas avec le temps. Cependant, en équilibre dynamique, en disant que les quantités ne changent pas ne signifie pas que la réaction s'est arrêtée. La réaction se déroule plutôt de manière à maintenir les montants inchangés (le changement net est nul).
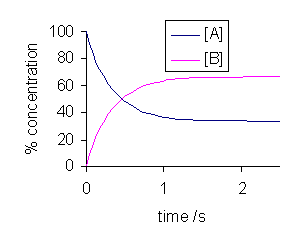
Figure 02: Changement des réactions avant et arrière dans un équilibre dynamique
Le mot «équilibre dynamique» signifie simplement que la réaction est réversible et continue. Pour qu'un équilibre dynamique ait lieu, le système doit être fermé, de sorte qu'aucune énergie ou matière ne s'échappe du système.
Quelle est la différence entre l'équilibre chimique et l'équilibre dynamique?
L'équilibre dynamique est un type d'équilibre chimique. La principale différence entre l'équilibre chimique et l'équilibre dynamique est que l'équilibre chimique décrit l'état à laquelle les concentrations de réactifs et de produits ne subissent aucun changement, tandis que l'équilibre dynamique décrit l'état à quel rapport réactif et produits ne change pas, mais les substances se déplacent entre les produits chimiques à un rythme égal.
De plus, dans un équilibre dynamique, la réaction se poursuit, mais la quantité de réactifs et de produits reste inchangée car les taux des réactions avant et arrière sont les mêmes. Il peut y avoir des cas en équilibre chimique où les quantités de produits et de réactifs restent inchangées car la réaction a cessé. C'est donc également une différence entre l'équilibre chimique et l'équilibre dynamique.
L'infographie ci-dessous sur la différence entre l'équilibre chimique et l'équilibre dynamique fournit plus d'informations sur ces différences.

Résumé - Équilibre chimique vs équilibre dynamique
Un équilibre est un état d'un système qui ne montre aucun changement net. L'équilibre chimique obtient cet état lorsque la réaction s'arrête tandis que l'équilibre dynamique obtient cet état lorsque les taux de réaction vers l'avant et vers l'arrière sont égaux. La principale différence entre l'équilibre chimique et l'équilibre dynamique est que l'équilibre chimique décrit l'état à laquelle les concentrations de réactifs et de produits ne subissent aucun changement, tandis que l'équilibre dynamique décrit l'état à laquelle le rapport des réactifs et des produits ne change pas, mais les substances se déplacer entre les produits chimiques à un rythme égal.
Référence:
1. «Équilibre chimique - types, principes et lois des équilibres.”Toppr Bytes, Toppr.com, 16 mars. 2018. Disponible ici
"Équilibre dynamique.”Wikipedia, Wikimedia Foundation, 17 décembre. 2018. Disponible ici
Image gracieuseté:
1.«ChemicalEquilibrium» par Fintelia - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Équilibre dynamique» par Petergans at English Wikipedia - Propre travaux (domaine public) via Commons Wikimedia


