Différence entre CFC et HCFC
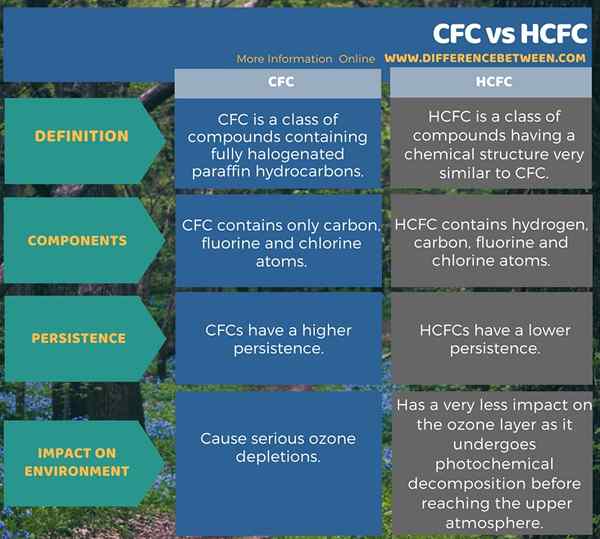
Le différence clé entre CFC et HCFC est que le CFC ne contient que des atomes de carbone, de fluor et de chlore tandis que HCFC contient des atomes d'hydrogène, de carbone, de fluor et de chlore. Plus important encore, le CFC provoque une déplétion grave de l'ozone, mais le HCFC, comparativement, a un impact bien moindre sur la couche d'ozone.
Les structures chimiques de CFC et de HCFC se rapportent les unes aux autres en fonction des éléments chimiques présents dans ces structures. Cependant, concernant la structure chimique, la différence entre CFC et HCFC est que le CFC n'a pas d'atome d'hydrogène tandis que le HCFC contient de l'atome d'hydrogène. CFC est bien connu en tant que contributeur à l'épuisement de l'ozone. Par conséquent, c'est une substance nocive. HCFC est un bon substitut à cette substance nocive.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que CFC
3. Qu'est-ce que HCFC
4. Comparaison côte à côte - CFC vs HCFC sous forme tabulaire
5. Résumé
Qu'est-ce que CFC?
CFC est une classe de composés qui contiennent des hydrocarbures de paraffine entièrement halogénés. Ces composés contiennent uniquement des atomes de carbone, de fluor et de chlore. Les atomes de carbone de ces composés forment des liaisons covalentes dans une symétrie tétraédrique. Les fabricants produisent ces composés comme des dérivés volatils du méthane, de l'éthane et du propane. Le nom de marque général de cette classe est «Freon». Le composé le plus courant de cette classe est le dichlorodifluorométhane. Les utilisations courantes de ces composés sont comme réfrigérants, propulseurs et comme solvants. Cependant, des recherches ultérieures ont révélé que ces composés contribuent à l'épuisement de l'ozone. Par conséquent, ces composés ont été remplacés par des composés inoffensifs tels que les HCFC.
De plus, les propriétés physiques de ces composés changent avec le nombre et le type d'halogène présent dans le composé. Généralement, ils sont volatils. Mais la volatilité est inférieure à celle de leurs molécules parentales (alcanes). Le moins de volatilité se produit en raison de la polarité moléculaire qui est induite par les halogénures; Ces halogénures entraînent des interactions intermoléculaires qui conduisent à augmenter le point d'ébullition, diminue ainsi la volatilité. Cependant, en raison de leur polarité, ces composés sont de bons solvants. De plus, leur point d'ébullition en fait de bons réfrigérants. En plus de cela, ces composés ont des densités plus élevées par rapport aux alcanes correspondants.

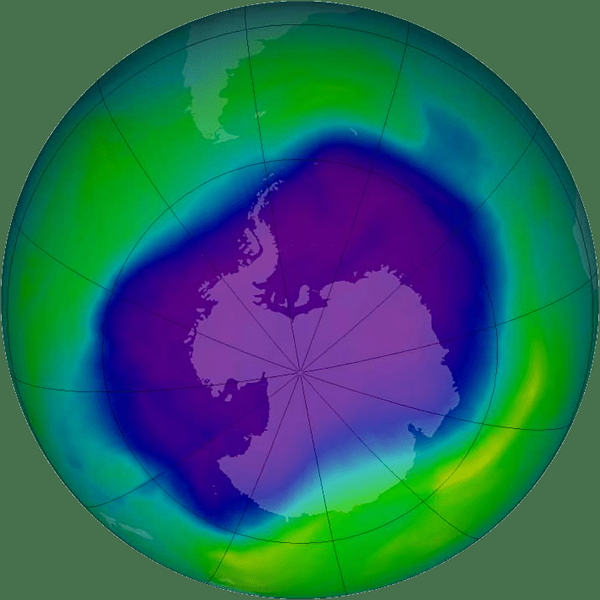
Figure 01: épuisement de l'ozone
De plus, la réaction la plus importante du CFC est la scission photo-induite d'une liaison C-CL. Nous pouvons l'écrire comme suit.
CCL3F → CCL2F. + CL.
Cette réaction forme du radical chlore. Il se comporte très différemment de la molécule de chlore; Cl2. Et ce radical vit longtemps dans la haute atmosphère. Là, il catalyse la conversion de l'ozone en molécules d'oxygène. Ainsi, il épuise la quantité d'ozone.
Qu'est-ce que HCFC?
HCFC est une classe de composés ayant une structure chimique très similaire à CFC. Cependant, contrairement au CFC, ces composés contiennent de l'atome d'hydrogène, en plus du carbone, du fluor et des atomes de chlore. Dans des conditions normales, ce sont des gaz ou des liquides très évaporatifs. Généralement, ils sont stables et non réactifs.
Ces composés sont des substituants très utiles pour les CFC. Ils sont utiles comme réfrigérants et en mousses insulatives. Cependant, les gens ne l'utilisent pas comme solvant, et il est interdit d'utiliser comme solvant dans de nombreux pays développés. Plus important encore, ces composés n'ont pas d'impacts immédiats sur l'environnement après avoir remis à l'environnement. En raison de leur nature volatile, ils peuvent impliquer dans des réactions qui produisent de l'ozone au niveau de l'atmosphère inférieure qui peut endommager les plantes. Puisqu'ils ne sont pas aussi stables que CFC et donc pas aussi persistants dans l'atmosphère, les effets sur l'atmosphère sont très moins. Mais encore, ces composés peuvent se retrouver dans la haute atmosphère provoquant une épuisement très lente de l'ozone.
Quelle est la différence entre CFC et HCFC?
CFC est une classe de composés qui contiennent des hydrocarbures de paraffine entièrement halogénés. Ces composés ne contiennent que des atomes de carbone, de fluor et de chlore. Plus important encore, CFC provoque une épuisement grave de l'ozone. HCFC est une classe de composés ayant une structure chimique très similaire à CFC. Mais ils contiennent de l'atome d'hydrogène, en plus du carbone, du fluor et des atomes de chlore. Cependant, HCFC a un impact très moins. C'est une différence importante entre CFC et HCFC.
Résumé - CFC vs HCFC
Les composés CFC et HCFC sont utiles comme réfrigérants, mais les CFC ne sont pas utilisés en raison de leurs impacts environnementaux graves. La principale différence entre CFC et HCFC est que le CFC ne contient que des atomes de carbone, de fluor et de chlore tandis que le HCFC contient de l'atome d'hydrogène en plus du carbone, du fluor et des atomes de chlore.
Référence:
1. «Chlorofluorocarbone.»Wikipedia, Wikimedia Foundation, 31 juillet 2018. Disponible ici
2. «Hydrochlorofluorocarbures (HCFCS).”Fiche d'information polluante. Disponible ici
Image gracieuseté:
1.«La NASA et la NOAA annoncent Ozone Hole est un double record» de la NASA (domaine public) via Commons Wikimedia


