Différence entre le carbonate et le bicarbonate
Le différence clé entre le carbonate et le bicarbonate L'ion carbonate a -2 charge électrique tandis que le bicarbonate a -1 charge électrique.
Le corps humain produit du dioxyde de carbone comme sous-produit du métabolisme. La plupart de ce dioxyde de carbone se dissout dans le plasma sanguin et présent sous forme de bicarbonate. Le système de carbonate et de bicarbonate est principalement responsable du maintien de notre valeur de pH du sang, et ils agissent comme un tampon dans notre sang. Lorsque le dioxyde de carbone se dissout dans l'eau, le bicarbonate et l'acide carbonique se forment, et il y a un équilibre entre ces espèces.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le carbonate
3. Qu'est-ce que le bicarbonate
4. Comparaison côte à côte - carbonate vs bicarbonate sous forme tabulaire
5. Résumé
Qu'est-ce que le carbonate?
Le carbonate est un ion inorganique contenant un atome de carbone et trois atomes d'oxygène. Il a une charge divalent négative (-2 charge électrique). L'ion carbonate a une géométrie planaire trigonale et son poids moléculaire est de 60 g de mol-1.
Bien que la structure Lewis de l'ion carbonate ait une double liaison en carbone-oxygène et deux liaisons simples en carbone-oxygène, ce n'est pas la structure réelle. L'ion carbonate montre la stabilisation de la résonance. Par conséquent, il a une structure hybride de toutes les structures de résonance. Par conséquent, toutes les liaisons en carbone-oxygène ont une longueur similaire, et les atomes d'oxygène ont une charge négative partielle (par conséquent, tous les atomes d'oxygène sont similaires.).
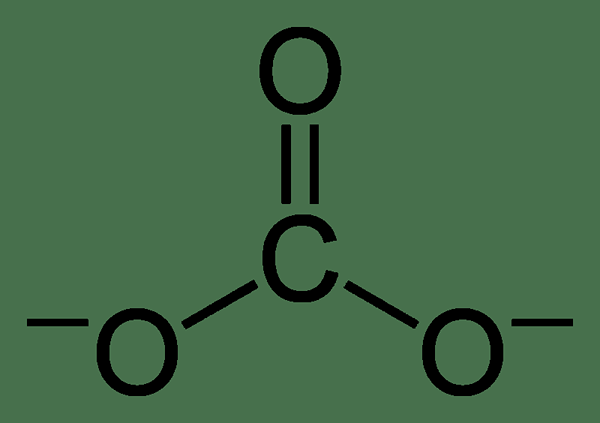
Figure 01: Structure chimique de l'ion carbonate
Lorsque le dioxyde de carbone ou le bicarbonate se dissout dans l'eau, les ions carbonatés se forment. Et, cet ion est en équilibre avec des ions bicarbonate. Naturellement, il se combine avec un autre ion métallique ou un autre ion positif pour faire des composés. Il existe différents types de roches de carbonate, telles que le calcaire (carbonate de calcium), la dolomite (carbonate de calcium-magnésium), la potasse (carbonate de potassium), etc.
De plus, les composés carbonatés jouent un rôle crucial dans le cycle du carbone. Avec le temps, les composés contenant du carbone se convertissent en roches sédimentaires lorsqu'ils se déposent pendant longtemps. Ensuite, lorsque ces rochers sont intempéries, le dioxyde de carbone est relâché dans l'atmosphère. De même, lors du chauffage de ces composés, ils libèrent facilement du dioxyde de carbone. De plus, les composés carbonatés sont ioniques et ils sont insolubles dans l'eau.
Qu'est-ce que le bicarbonate?
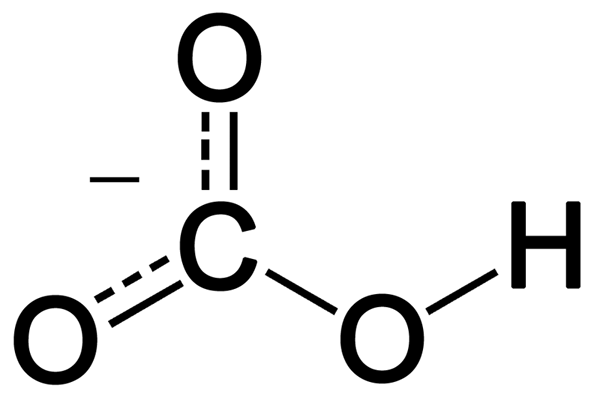
Le bicarbonate est un anion monovalent ayant un hydrogène, un carbone et trois atomes d'oxygène. Il se forme à partir de déprotonation de l'acide carbonique. Il a une géométrie plane trigonale autour de l'atome de carbone central. L'ion bicarbonate a un poids moléculaire de 61 g de mol-1.

Figure 02: Structure de résonance de l'ion bicarbonate
De plus, cet ion montre une stabilisation de résonance entre les deux atomes d'oxygène, qui ne sont pas liés à l'hydrogène. De nature, le bicarbonate est alcalin, et c'est l'acide conjugué de l'ion carbonate et la base conjuguée de l'acide carbonique. De plus, les ions chargés positivement peuvent se combiner avec l'oxygène chargé négativement dans cet ion et former des sels ioniques. Le sel le plus commun du bicarbonate est le bicarbonate de sodium, que nous nommons comme poudre à pâte à utiliser quotidien. De plus, les composés de bicarbonate libèrent du dioxyde de carbone lorsqu'ils réagissent avec les acides.
Quelle est la différence entre le carbonate et le bicarbonate?
Le carbonate et le bicarbonate sont des anions inorganiques. La principale différence entre le carbonate et le bicarbonate est que l'ion carbonate a -2 charge électrique tandis que le bicarbonate a -1 charge électrique. De plus, en raison de la présence de l'atome d'hydrogène, la masse molaire de l'ion carbonate est de 60 g / mol tandis que la masse molaire de l'ion bicarbonate est de 61 g / mol.
Une autre différence significative entre le carbonate et le bicarbonate est que, dans des conditions fortement basiques, il y aura plus d'ions carbonatés, tandis que les ions bicarbonate seront plus en solution de base faible. De plus, la capacité de se dissoudre dans l'eau contribue également à une différence entre le carbonate et le bicarbonate. C'est-à-dire; Les composés avec des ions carbonatés ne sont pas solubles dans l'eau à la température ambiante et la pression atmosphérique. Cependant, de nombreux sels de bicarbonate sont solubles dans l'eau à température ambiante.
Vous trouverez ci-dessous un résumé de la différence entre le carbonate et le bicarbonate sous forme tabulaire.
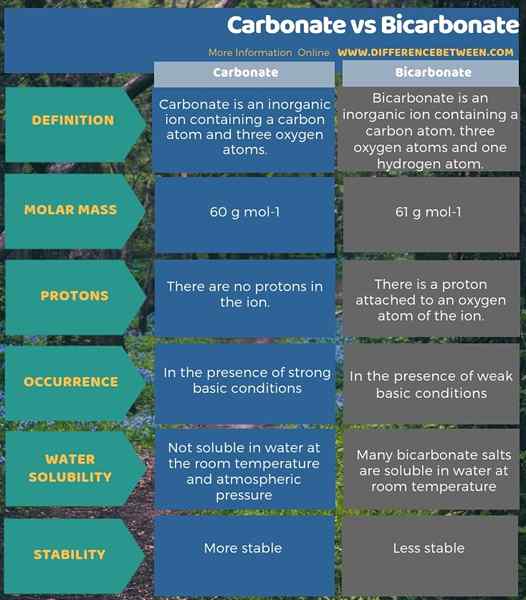
Résumé - Carbonate vs bicarbonate
Le carbonate et le bicarbonate sont des ions contenant des atomes de carbone et d'oxygène. Cependant, l'ion bicarbonate a également un atome d'hydrogène. Par conséquent, cet atome d'hydrogène fait que l'ion devient des anions monovalents tandis que le carbonate est un anion divalent. En résumé, la principale différence entre le carbonate et le bicarbonate est que l'ion carbonate a -2 charge électrique tandis que le bicarbonate a -1 charge électrique.
Référence:
1. Britannica, les éditeurs de l'Encyclopaedia. "Carbonate.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 juillet 1998. Disponible ici
2. «Ion bicarbonate.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.«Carbonate-ion-localisé-2d» par Ben Mills - Propre travaux, (domaine public) via Commons Wikimedia
2.«Bicarbonate-Resonance» par Hellbus - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


