Différence entre le carbone et le diamant
Le différence clé entre le carbone et le diamant Le carbone est un élément chimique tandis que le diamant est un allotrope de carbone.
Le carbone est un élément chimique ayant le numéro atomique 6 et le symbole chimique C. Il se produit dans la nature dans différentes structures, que nous appelons des allotropes de carbone. Ces structures ne contiennent que du carbone comme élément chimique, mais la disposition spatiale des atomes de carbone est différente les unes des autres. Le diamant est également un type d'allotrope. Les propriétés physiques des allotropes sont également différentes les unes des autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le carbone
3. Qu'est-ce que le diamant
4. Comparaison côte à côte - carbone vs diamant sous forme tabulaire
5. Résumé
Qu'est-ce que le carbone?
Le carbone est un élément chimique ayant le numéro atomique 6 et le symbole chimique C. Il s'agit d'un non-métal situé comme un élément de bloc P dans le tableau périodique des éléments. Selon la configuration électronique du carbone ([il] 2s2 2p2), un atome de carbone peut former quatre liaisons chimiques covalentes. De plus, cet élément a des isotopes (atomes du même élément ayant des nombres différents de neutrons). L'isotope du carbone le plus abondant et le plus stable est de 12 ° C 13C est un isotope stable mais moins abondant; 14C, en revanche, est un isotope radioactif.
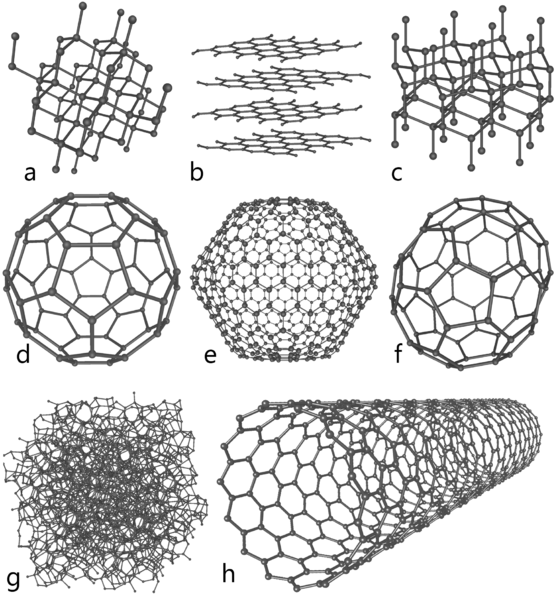
Figure 01: Allotropes de carbone
Les allotropes de carbone sont les différentes formes structurelles de carbone qui n'ont que des atomes de carbone mais des arrangements spatiaux différents. Ce sont les formes de carbone naturelles. Les exemples les plus courants sont le diamant et le graphite. Bien que ces deux structures se composent uniquement d'atomes de carbone, ils ont des propriétés physiques différentes en raison des différences d'arrangement spatial. Par exemple, le diamant est transparent tandis que le graphite est opaque. De plus, certains autres faits chimiques sur le carbone sont répertoriés comme suit:
- Le numéro atomique est de 6
- Le numéro de masse est 12.011
- Groupe 14 et période 2
- Élément de bloc P
- Non-métal réactif
- À température et à la pression standard, elle se produit à l'état solide
- Le point de sublimation est de 3642 ° C
- Triple Point est de 4600 K, 10 800 kPa
- L'état d'oxydation le plus courant est +4
Qu'est-ce que le diamant?
Le diamant est un allotrope de carbone. C'est une forme solide de carbone qui a une forme tridimensionnelle. De plus, chaque atome de carbone se fixe avec quatre autres atomes de carbone via une liaison chimique covalente. Et, cette structure cristalline est appelée structure «diamant cubique». De plus, parmi tous les matériaux naturels, ce composé a la dureté et la conductivité thermique la plus élevée. Par conséquent, le diamant est courant dans les industries pour la coupe et le polissage.

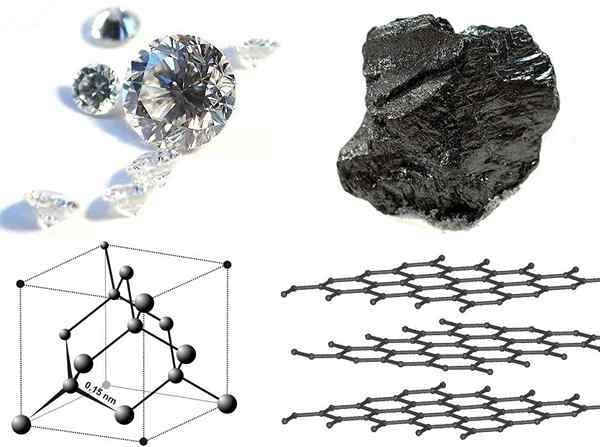
Figure 02: Diamond vs Graphite
Certains faits importants sur le diamant sont les suivants:
- Tombe dans la catégorie des minéraux indigènes
- L'unité de répétition est le carbone
- La masse de formule est 12.01 g / mol
- La couleur est généralement jaune, marron ou gris à colori
- La fracture est irrégulière / inégale
- De plus, sa séquence minérale est incolore
Quelle est la différence entre le carbone et le diamant?
Le carbone est un élément chimique ayant un numéro 6 atomique et un symbole chimique C tandis que le diamant est l'allotrope le plus fort du carbone. La principale différence entre le carbone et le diamant est que le carbone est un élément chimique tandis que le diamant est un allotrope de carbone. De plus, l'apparition du carbone dépend du type d'allotrope, e.Le graphite G a une couleur foncée et est opaque tandis que le diamant est transparent et apparaît généralement jaune, marron ou gris à colorier. Bien que la plupart des allotropes de carbone aient une résistance plus faible, le diamant est les matériaux les plus forts qui se produisent naturellement sur Terre.
Le tableau suivant présente la différence entre le carbone et le diamant.

Résumé - Carbone vs Diamond
Le carbone a de nombreux allotropes courants tandis que la structure la plus forte d'entre eux est le diamant. Ainsi, la principale différence entre le carbone et le diamant est que le carbone est un élément chimique alors que le diamant est un allotrope de carbone.
Référence:
1. "Carbone.»Wikipedia, Wikimedia Foundation, 26 avril. 2019, disponible ici.
2. "Diamant.»Géologie.com, disponible ici.
Image gracieuseté:
1. «Huit allotropes de carbone» par créé par Michael Ströck (mstroeck) - (CC By-Sa 3.0) via Commons Wikimedia
2. "Diamond et Graphite2" par Diamond_and_Graphite.JPG: Utilisateur: ITUBDERIVative Travail: MaterialScientist (Talk) - Diamond_and_graphite.jpgfile: graphite-tn19a.JPG (CC BY-SA 3.0) via Commons Wikimedia


