Différence entre l'énergie des liaisons et l'enthalpie des liaisons
Différence clé - Énergie de liaison vs enthalpie des liaisons
L'énergie des liaisons et l'enthalpie des liaisons décrivent le même concept chimique; la quantité d'énergie nécessaire pour séparer une taupe de molécules dans ses atomes composants. Cela mesure la force d'une liaison chimique. Par conséquent, il est aussi appelé la force de liaison. L'énergie de liaison est calculée comme une valeur moyenne des énergies de dissociation des liaisons à 298 K pour les espèces chimiques en phase gazeuse. Il n'y a pas de différence considérable entre les termes Bond Energy et l'enthalpie des liaisons, mais L'énergie de liaison est indiquée par «e» tandis que l'enthalpie des liaisons est indiquée par «H".
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'énergie de liaison
3. Qu'est-ce que l'enthalpie du lien
4. Comparaison côte à côte - Énergie de liaison vs enthalpie de liaison sous forme tabulaire
5. Résumé
Qu'est-ce que l'énergie de liaison?
L'énergie des obligations ou l'enthalpie des obligations est une mesure de la résistance aux liaisons. L'énergie de liaison est la quantité d'énergie nécessaire pour séparer une mole de molécules dans ses atomes de composants. Cela signifie que l'énergie de liaison est l'énergie nécessaire pour briser une liaison chimique. L'énergie des liaisons est indiquée comme «E». L'unité de mesure est kJ / mol.
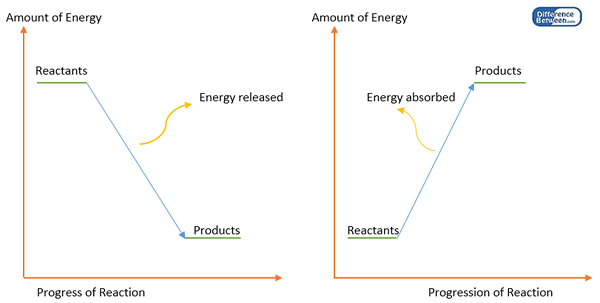
Des liaisons chimiques se forment entre les atomes afin d'obtenir un état stable lorsque les atomes individuels ont une énergie élevée qui est instable. Cela signifie que la formation de liaisons chimiques diminue l'énergie d'un système. Par conséquent, une partie de l'énergie est libérée (généralement sous la chaleur) lors de la formation de liaisons chimiques. Par conséquent, la formation de liaison est une réaction exothermique. Afin de briser cette liaison chimique, l'énergie doit être fournie (une quantité égale d'énergie à celle de l'énergie libérée pendant la formation de liaison). Cette quantité d'énergie est connue sous le nom d'énergie de liaison ou d'enthalpie de liaison.

Figure 1: Diagramme d'énergie pour la formation de liaisons (à gauche) et la dissociation des liaisons (à droite).
L'énergie de liaison est égale à la différence entre l'enthalpie des produits (atomes) et des réactifs (molécule de départ). Chaque molécule devrait avoir ses propres valeurs d'énergie de liaison. Mais il y a des exceptions. Par exemple, l'énergie de liaison de la liaison C-H dépend de la molécule où la liaison se produit. Par conséquent, l'énergie de liaison est calculée comme une valeur moyenne des énergies de dissociation des liaisons.
L'énergie de liaison est les énergies de dissociation des liaisons moyennes pour la même espèce en phase gazeuse (à 298 K de température). Par exemple, l'énergie liée de la molécule de méthane (ch4) est la quantité d'énergie nécessaire pour former un atome de carbone et 4 radicaux hydrogène. Ensuite, l'énergie de liaison de la liaison C-H peut être calculée en prenant la somme des énergies de dissociation des liaisons de chaque liaisons C-H et en divisant la valeur totale de 4 de 4.
Ex: Énergie de la liaison de la liaison O-H dans H2O La molécule peut être calculée comme suit.
Quantité d'énergie requise pour briser la liaison H-OH = 498.7 kJ / mol
La quantité d'énergie nécessaire pour briser la liaison O-H (dans le Radical OH restant) = 428 kJ / mol
L'énergie moyenne de dissociation des liaisons = (498.7 + 428) / 2
= 463.35 kJ / mol ≈ 464 kJ / mol
Par conséquent, l'énergie de liaison de O-H en h2O molécule est considérée comme 464 kJ / mol.
Qu'est-ce que l'enthalpie du lien?
L'enthalpie de liaison ou l'énergie de liaison est la quantité d'énergie nécessaire pour séparer une molécule en ses composants atomiques. C'est une mesure de la résistance aux liaisons. L'enthalpie du lien est indiquée comme «H».
Quelle est la différence entre l'énergie des liaisons et l'enthalpie des liaisons?
- L'énergie de liaison ou l'enthalpie des liaisons est la quantité d'énergie nécessaire pour briser une mole de molécules dans ses atomes de composants.
- L'énergie des liaisons est indiquée comme «E» tandis que l'enthalpie des obligations est indiquée comme «H».
Résumé - Énergie de liaison vs enthalpie des obligations
L'enthalpie d'énergie ou de liaison est la quantité d'énergie nécessaire pour séparer une mole de molécules dans ses composantes atomiques en phase gazeuse. Il est calculé en utilisant les valeurs d'énergie de dissociation des liaisons des liaisons chimiques. Par conséquent, l'énergie de liaison est la valeur moyenne des énergies de dissociation des liaisons. C'est toujours une valeur positive car la dissociation des liaisons est endothermique (la formation des liaisons est exothermique). Il n'y a pas de différence considérable entre l'énergie des liaisons et l'enthalpie des liaisons.
Référence:
1. «Énergies de liaison.”Chemistry LibreTexts, LibreTexts, 20 janvier. 2017, disponible ici.
2. Helmenstine, Anne Marie. «Qu'est-ce que l'énergie de liaison?”Thoughtco, disponible ici.
3. «Énergie de liaison.»Wikipedia, Wikimedia Foundation, 13 mars. 2018, disponible ici.


