Différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons
Le différence clé entre l'énergie des liaisons et l'énergie de dissociation des liaisons est que le L'énergie des obligations est une valeur moyenne tandis que l'énergie de dissociation des liaisons est une valeur particulière pour une obligation particulière.
Comme proposé par le chimiste américain G.N.Lewis, les atomes sont stables lorsqu'ils contiennent huit électrons dans leur coquille de valence. La plupart des atomes ont moins de huit électrons dans leurs coquilles de valence (à l'exception des gaz nobles dans le groupe 18 du tableau périodique); Par conséquent, ils ne sont pas stables. Par conséquent, ces atomes ont tendance à réagir entre eux, pour devenir stable. Il peut se produire en formant des liaisons ioniques, des liaisons covalentes ou des liaisons métalliques en fonction de l'électronégativité des atomes. Lorsque deux atomes ont une différence d'électronégativité similaire ou très faible, réagissez ensemble, ils forment une liaison covalente en partageant des électrons. L'énergie des liaisons et l'énergie de dissociation des liaisons sont deux concepts concernant les liaisons chimiques covalentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'énergie de liaison
3. Qu'est-ce que l'énergie de dissociation des liaisons
4. Comparaison côte à côte - Énergie de liaison vs énergie de dissociation des liaisons sous forme tabulaire
5. Résumé
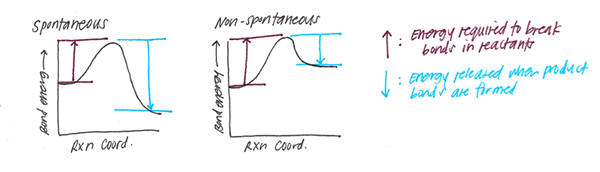
Qu'est-ce que l'énergie de liaison?
Lorsque les obligations se forment, une certaine quantité de versions d'énergie. En revanche, la rupture des liaisons nécessite une certaine quantité d'énergie. Pour une certaine liaison chimique, cette énergie est constante. Et nous l'appelons comme l'énergie de la liaison. Ainsi, l'énergie de liaison est la quantité de chaleur nécessaire pour briser une mole de molécules dans ses atomes correspondants.
De plus, nous pouvons observer l'énergie d'une liaison chimique sous diverses formes comme énergie chimique, énergie mécanique ou énergie électrique. Cependant, finalement, toutes ces énergies se transforment en chaleur. Par conséquent, nous pouvons mesurer l'énergie de la liaison à Kilojoule ou à Kilocalorie.

Figure 01: Énergie de la liaison
De plus, l'énergie de liaison est un indicateur de la résistance à la liaison. Par exemple, les liaisons plus fortes sont difficiles à cliver. Par conséquent, les énergies de liaison sont plus grandes. D'un autre côté, les liaisons faibles ont de petites énergies de liaison, et elles sont faciles à cliver. L'énergie de liaison indique également la distance de liaison. Des énergies de liaison plus élevées signifient que la distance de liaison est faible (par conséquent, la résistance à la liaison est élevée). De plus, lorsque l'énergie de liaison est une faible distance de liaison est plus élevée. Comme mentionné dans l'introduction, l'électronégativité joue un rôle dans la formation de liaisons. Par conséquent, l'électronégativité des atomes contribue également à l'énergie de la liaison.
Qu'est-ce que l'énergie de dissociation des liaisons?
L'énergie de dissociation des liaisons est également une mesure de la résistance à la liaison. Nous pouvons le définir comme le changement d'enthalpie qui se déroule lorsqu'un lien subit un clivage par homolyse. L'énergie de dissociation des liaisons est spécifique à une seule liaison.
Dans ce cas, le même lien peut avoir des énergies de dissociation des liaisons différentes selon la situation. Par exemple, il y a quatre liaisons C-H dans une molécule de méthane, et toutes les liaisons C-H n'ont pas la même énergie de dissociation des liaisons.

Figure 02: Certaines énergies de dissociation des liaisons pour les complexes de coordination
Par conséquent, dans la molécule de méthane, les énergies de dissociation des liaisons pour les liaisons C-H sont de 439 kJ / mol, 460 kJ / mol, 423 kJ / mol et 339 kJ / mol. C'est parce que la première rupture de liaison forme une espèce radicale via l'homolyse, ainsi la deuxième rupture de liaison se produit à partir d'une espèce radicale, qui nécessite plus d'énergie que la première. De même, étape par étape, les énergies de dissociation des liaisons changent.
Quelle est la différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons?
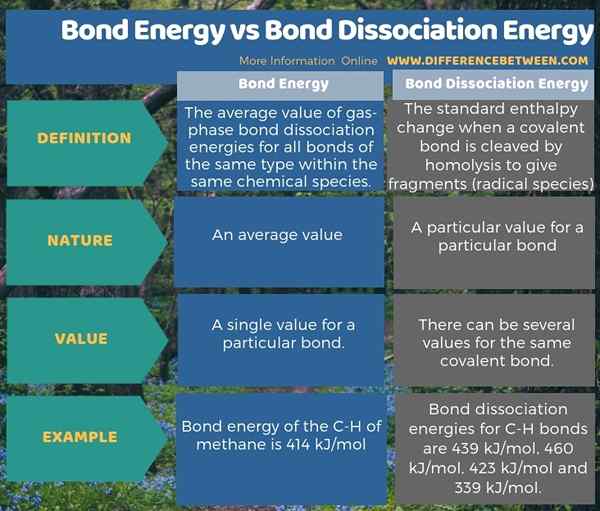
L'énergie des liaisons est la valeur moyenne des énergies de dissociation des liaisons en phase gazeuse (généralement à une température de 298 K) pour toutes les liaisons du même type au sein de la même espèce chimique. Cependant, l'énergie des liaisons et l'énergie de dissociation des liaisons ne sont pas les mêmes. L'énergie de dissociation des liaisons est le changement d'enthalpie standard lorsqu'une liaison covalente est clivée par l'homolyse pour donner des fragments; qui sont généralement des espèces radicales. Par conséquent, la principale différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons est que l'énergie de liaison est une valeur moyenne tandis que l'énergie de dissociation des liaisons est une valeur particulière pour une liaison particulière.
Par exemple, dans la molécule de méthane, les énergies de dissociation des liaisons pour les liaisons C-H sont de 439 kJ / mol, 460 kJ / mol, 423 kJ / mol et 339 kJ / mol. Cependant, l'énergie de liaison du C-H du méthane est de 414 kJ / mol, ce qui est la moyenne des quatre valeurs. De plus, pour une molécule, l'énergie de dissociation des liaisons ne peut pas nécessairement être égale à l'énergie de la liaison (comme pour l'exemple de méthane pré-donné). Pour une molécule diatomique, l'énergie de liaison et l'énergie de dissociation des liaisons sont les mêmes.
Ci-dessous l'infographie sur la différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons fournit plus de détails sur les différences.
Résumé - Énergie des liaisons vs énergie de dissociation des obligations
L'énergie de dissociation des liaisons est différente de l'énergie de liaison. L'énergie de liaison est la valeur moyenne de toutes les énergies de dissociation des liaisons d'une molécule. Par conséquent, la principale différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons est que l'énergie de liaison est une valeur moyenne tandis que l'énergie de dissociation des liaisons est une valeur particulière pour une liaison particulière.
Référence:
1. «Énergie de dissociation des liaisons.»Wikipedia, Wikimedia Foundation, 5 janvier. 2019. Disponible ici
2. LibreTexts. «Énergies de liaison.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Bond Energy Diagrams» par FBarreyro - Propre travaux, (domaine public) via Commons Wikimedia
2.«Bond Energies» par Chem540F09Grp8 - Propre travaux, (domaine public) via Commons Wikimedia


