Différence entre le modèle Bohr et Rutherford
Différence clé - modèle Bohr vs Rutherford
Le concept des atomes et leur structure ont été introduits pour la première fois par John Dolton en 1808. Il a expliqué les lois de la combinaison chimique en considérant les atomes comme des particules invisibles sans structure. Puis en 1911, le physicien néo-zélandais Ernest Rutherford a proposé que les atomes se composent de deux composants: un noyau chargé positivement au centre de l'atome et des électrons chargés négativement dans la partie extranucléaire de l'atome. Certaines théories telles que la théorie électromagnétique présentée par Maxwell n'ont pas pu être expliquées avec le modèle de Rutherford. En raison de ces limites dans le modèle de Rutherford, le physicien danois Niels Bohr a proposé un nouveau modèle en 1913 basé sur la théorie quantique des radiations. Le modèle de Bohr a été largement accepté et il a reçu le prix Nobel pour son travail. Même s'il a été largement accepté, il comporte toujours certains inconvénients et limitations. La principale différence entre le modèle Bohr et le modèle de Rutherford est que Dans le modèle de Rutherford, les électrons peuvent tourner dans n'importe quelle orbite autour du noyau, tandis que dans le modèle Bohr, les électrons peuvent tourner dans une coquille définie.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le modèle Bohr
3. Qu'est-ce que le modèle Rutherford
4. Comparaison côte à côte - modèle Bohr vs Rutherford sous forme tabulaire
6. Résumé
Qu'est-ce que le modèle Bohr?
Le modèle de Bohr a été proposé par Niels Bohr en 1922 pour expliquer la structure de l'atome. Dans ce modèle, Bohr a mentionné que la majeure partie de la masse atomique réside dans le noyau central qui contient des protons et des électrons est disposée en niveaux d'énergie définis et tourne autour du noyau. Le modèle a également proposé une configuration électronique, qui explique la disposition des électrons dans les orbites circulaires désignées par k, l, m, n, etc. Les atomes avec des configurations d'électrons complètes ne sont pas actifs. La configuration d'électrons détermine la réactivité de l'atome.

Figure 01: modèle Bohr
Le modèle de Bohr est capable d'expliquer le spectre de l'atome d'hydrogène, mais il ne peut pas expliquer pleinement la réactivité des atomes multitoliques. De plus, il n'explique pas l'effet Zeeman, où chaque ligne spectrale s'est divisée en plus de lignes en présence d'un champ magnétique externe. Dans ce modèle, un électron n'est considéré que comme une particule. Cependant, un physicien français, de Broglie, a découvert que les électrons ont des propriétés d'ondes et de particules. Plus tard, un physicien a présenté un autre principe appelé le principe d'incertitude de Heisenberg, qui explique l'impossibilité de la détermination simultanée de la position exacte et de l'élan des petites particules en mouvement telles que les électrons. Avec cette invention, le modèle de Bohr a été confronté à un revers sérieux.
Qu'est-ce que le modèle Rutherford?
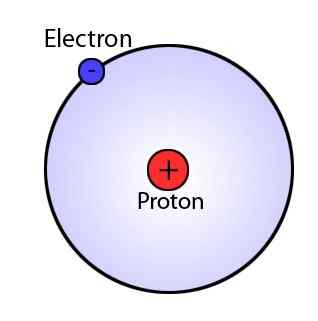
En 1911, Ernest Rutherford a proposé le modèle de Rutherford. Il indique que l'atome (le volume) se compose principalement d'espace et que la masse de l'atome est centrée dans le noyau, qui est le noyau de l'atome. Le noyau est chargé positivement et l'orbite électronique autour du noyau. Les orbites n'ont pas de chemins définis. De plus, comme les atomes sont neutres, ils ont des charges positives (dans le noyau) et négatives égales (électrons).

Figure 02: Rutherford Atom
Le modèle de Rutherford n'a pas expliqué la théorie électromagnétique, la stabilité de l'atome et l'existence de lignes définies dans le spectre d'hydrogène.
Quelle est la différence entre le modèle Bohr et Rutherford?
Modèle Bohr vs Rutherford | |
| Le modèle Bohr a été proposé par Niels Bohr en 1922. | Le modèle Rutherford a été proposé par Ernest Rutherford en 1911. |
| Théorie | |
| La majeure partie de la masse atomique se trouve dans le noyau central, qui contient des protons, et les électrons sont disposés en niveaux d'énergie ou coquilles définies. | La plupart de l'atome se compose d'un espace vide. Le centre de l'atome contient un noyau chargé positivement et ses électrons chargés négativement sont présents dans l'espace entourant le noyau. |
| Émission de rayonnement des électrons | |
| Les électrons n'émettent que des vagues de fréquences définies. | Les électrons émettent des vagues de toutes les fréquences. |
| Spectre d'émission d'électrons | |
| Le spectre d'émission d'électrons est un spectre de ligne. | Le spectre d'émission d'électrons est un spectre continu. |
Résumé - Bohr vs Rutherford Model
Les modèles Bohr et Rutherford sont des modèles planétaires qui expliquent la structure atomique dans une certaine mesure. Ces modèles ont des limites et n'expliquent pas certains principes modernes de la physique. Cependant, ces modèles contribuent grandement aux modèles avancés modernes qui expliquent la structure atomique. Le modèle Bohr indique que la majeure partie de la masse atomique se trouve dans le noyau central, qui contient des protons et, que les électrons sont disposés en niveaux d'énergie ou coquilles d'énergie définies, résultant en spectre de ligne d'électrons. Le modèle de Rutherford stipule que la majeure partie de l'atome se compose d'un espace vide et que le centre de l'atome contient un noyau chargé positivement entouré d'électrons chargés négativement, résultant en spectre d'électrons continu. C'est la différence entre le modèle Bohr et Rutherford.
Télécharger la version PDF du modèle Bohr vs Rutherford
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon les notes de citation. Veuillez télécharger la version PDF ici différence entre Bohr et Rutherford Model.
Les références:
1. Tarendash, un. S. Prenons l'examen: chimie, le cadre physique. Barron's Educational Series, 2006. Imprimer.
2. Warren, D. Chimistes dans un contexte social et historique: les chimistes sont de vraies personnes, vivant dans le monde réel. Royal Society of Chemistry, 2001. Imprimer.
Image gracieuseté:
1. «Bohr Model» par Jia.Liu - propre travail (domaine public) via Commons Wikimedia
2. «Rutherford Atom» par son propre travail (CreateJoder XD XD) (CC BY-SA 3.0) via Commons Wikimedia


