Différence entre Bohr et le modèle quantique
Différence clé - Bohr vs Quantum Model
Le modèle Bohr et le modèle quantique sont des modèles qui expliquent la structure d'un atome. Le modèle Bohr est également appelé modèle Rutherford-Bohr car il s'agit d'une modification du modèle Rutherford. Le modèle Bohr a été proposé par Niels Bohr en 1915. Le modèle quantique est le modèle moderne d'un atome. La principale différence entre Bohr et le modèle quantique est que Le modèle Bohr déclare que les électrons se comportent comme des particules alors que Le modèle quantum explique que l'électron a un comportement à la bite et aux ondes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le modèle Bohr
3. Qu'est-ce que le modèle quantique
4. Comparaison côte à côte - modèle Bohr vs quantum sous forme tabulaire
5. Résumé
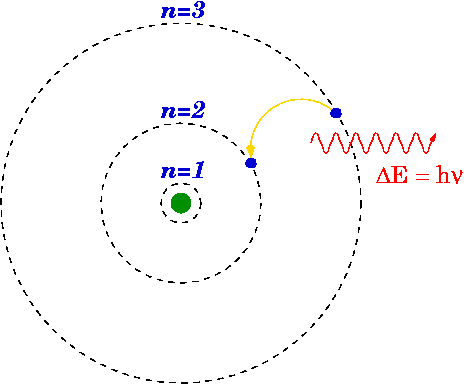
Qu'est-ce que le modèle Bohr?
Comme mentionné ci-dessus, le modèle Bohr est une modification du modèle Rutherford puisque le modèle Bohr explique la structure de l'atome comme composé d'un noyau entouré d'électrons. Mais le modèle Bohr est plus avancé que le modèle Rutherford car il dit que les électrons se déplacent toujours dans des coquilles ou des orbites spécifiques autour du noyau. Cela indique également que ces coquilles ont des énergies différentes et sont de forme sphérique. Qui a été suggéré par des observations des spectres de ligne pour l'atome d'hydrogène.
En raison de la présence de lignes discrètes dans les spectres de ligne, Bohr a déclaré que les orbitales d'un atome ont des énergies fixes et des électrons peuvent sauter d'un niveau d'énergie à l'autre émetteur ou absorber l'énergie, résultant en une ligne dans les spectres de ligne.
Postulates principaux du modèle Bohr
-
Les électrons se déplacent autour du noyau dans les orbitales sphériques qui ont une taille et une énergie fixe.
- Chaque orbite a un rayon différent et est nommé du noyau à l'extérieur comme n = 1, 2, 3, etc. ou n = k, l, m, etc. où n est le numéro de niveau d'énergie fixe.
- L'énergie d'une orbitale est liée à sa taille.
- La plus petite orbite a la plus faible énergie. L'atome est complètement stable lorsque les électrons sont dans le niveau d'énergie le plus bas.
- Lorsqu'un électron se déplace dans une certaine orbitale, l'énergie de cet électron est constante.
- Les électrons peuvent passer d'un niveau d'énergie à un autre en absorbant ou en libérant de l'énergie.
-
Ce mouvement provoque des rayonnements.
Le modèle bohr s'adapte parfaitement à l'atome d'hydrogène qui a un seul électron et un petit noyau chargé positivement. En dehors de cela, Bohr a utilisé la constante de la planche pour calculer l'énergie des niveaux d'énergie de l'atome.

Figure 01: Le modèle Bohr pour l'hydrogène
Mais il y avait peu d'inconvénients du modèle Bohr lors de l'explication de la structure atomique des atomes autres que l'hydrogène.
Limites du modèle Bohr
- Le modèle Bohr n'a pas pu expliquer l'effet Zeeman (effet du champ magnétique sur le spectre atomique).
- Il n'a pas pu expliquer l'effet brut (effet du champ électrique sur le spectre atomique).
- Le modèle Bohr ne parvient pas à expliquer les spectres atomiques des atomes plus grands.
Qu'est-ce que le modèle quantique?
Bien que le modèle quantique soit beaucoup plus difficile à comprendre que le modèle Bohr, il explique avec précision les observations concernant les atomes grands ou complexes. Ce modèle quantique est basé sur la théorie quantique. Selon la théorie quantique, un électron a une dualité à ondes de particules et il est impossible de localiser la position exacte de l'électron (principe d'incertitude). Ainsi, ce modèle est principalement basé sur la probabilité qu'un électron soit situé n'importe où dans l'orbital. Il indique également que les orbitales ne sont pas toujours sphériques. Les orbitales ont des formes particulières pour différents niveaux d'énergie et sont des structures 3D.
Selon le modèle quantique, un électron peut recevoir un nom avec l'utilisation de nombres quantiques. Quatre types de nombres quantiques sont utilisés dans ce domaine;
- Principe numéro quantique, n
- Numéro quantique de moment angulaire, i
- Numéro quantique magnétique, ml
- Numéro quantique de spin, ms
Le Numéro quantique principal Explique la distance moyenne de l'orbitale du noyau et du niveau d'énergie. Le Numéro quantique de moment angulaire explique la forme de l'orbitale. Le Numéro quantique magnétique décrit l'orientation des orbitales dans l'espace. Le Numéro quantique de spin donne la filature d'un électron dans un champ magnétique et les caractéristiques des vagues de l'électron.
Figure 2: Structure spatiale des orbitales atomiques.
Quelle est la différence entre Bohr et le modèle quantique?
Modèle Bohr vs quantum | |
| Le modèle Bohr est un modèle atomique proposé par Niels Bohr (en 1915) pour expliquer la structure d'un atome. | Le modèle quantique est un modèle atomique qui est considéré comme le modèle atomique moderne pour expliquer avec précision la structure d'un atome. |
| Comportement des électrons | |
| Le modèle Bohr explique le comportement des particules d'un électron. | Le modèle quantique explique la dualité ondulée-particule d'un électron. |
| Applications | |
| Le modèle bohr peut être appliqué pour l'atome d'hydrogène mais pas pour les grands atomes. | Le modèle quantique peut être utilisé pour n'importe quel atome, y compris les plus petits et les grands atomes complexes. |
| Forme des orbitales | |
| Le modèle Bohr ne décrit pas les formes exactes de chaque orbitale. | Le modèle quantum décrit les formes toutes les possibles qu'une orbitale peut avoir. |
| Effets électro-magnétiques | |
| Le modèle Bohr n'explique pas l'effet Zeeman (effet du champ magnétique) ou l'effet stark (effet du champ électrique). | Le modèle quantique explique les effets Zeeman et Stark précisément. |
| Nombres quantiques | |
| Le modèle Bohr ne décrit pas les nombres quantiques autres que le principal numéro quantique. | Le modèle quantique décrit les quatre nombres quantiques et les caractéristiques d'un électron. |
Résumé - Bohr vs Quantum Model
Bien que plusieurs modèles atomiques différents aient été proposés par des scientifiques, les modèles les plus notables étaient le modèle Bohr et le modèle quantique. Ces deux modèles sont étroitement liés, mais le modèle quantique est beaucoup plus détaillé que le modèle Bohr. Selon le modèle Bohr, un électron se comporte comme une particule alors que le modèle quantique explique que l'électron a à la fois un comportement de particules et d'ondes. C'est la principale différence entre Bohr et le modèle quantique.
Télécharger la version PDF du modèle Bohr vs Quantum
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon les notes de citation. Veuillez télécharger la version PDF ici différence entre Bohr et le modèle quantique.
Les références:
1. «Modèle Bohr d'un atome | Théorie atomique de Schrodinger." Chimie. Classes ByJus, 08 novembre. 2016. la toile. Disponible ici. 05 juin 2017.
2. «Structure atomique: le modèle mécanique quantique." Nuls. N.p., n.d. la toile. Disponible ici. 05 juin 2017.
Image gracieuseté:
1. «Bohr Model Balmer 32» (CC BY-SA 3.0) via Commons Wikimedia
2. «Atom Clipart Violet» (domaine public) via Commons Wikimedia


