Différence entre les ligands bidentés et ambidents
Différence clé - bidentate vs Ambidente Ligands
Le différence clé Entre les ligands bidentés et ambidents est que Les ligands bidentés peuvent se lier à un atome central via deux liaisons en même temps tandis que les ligands ambidents peuvent former deux liaisons avec un atome central, mais former une seule liaison à la fois.
Les ligands sont des molécules ou des anions riches en électrons qui peuvent donner des paires d'électrons solitaires à un atome qui a une charge électrique positive. Il existe plusieurs types de ligands nommés ligands monodentés, ligands bidentés, ligands de polydentate, etc. en fonction du nombre de liaisons qu'ils peuvent former avec un atome.
CONTENU
1. Aperçu et différence clé
2. Que sont les ligands bidentés
3. Que sont les ligands ambidents
4. Similitudes entre les ligands bidentés et ambidents
5. Comparaison côte à côte - bidenté vs ligands ambidenate sous forme tabulaire
6. Résumé
Que sont les ligands bidentés?
Les ligands bidentés sont des molécules ou des anions qui peuvent se lier à un atome via deux liaisons covalentes de coordonnées. Les liaisons covalentes coordonnées sont un type de liaisons covalentes qui se forment lorsqu'une espèce chimique riche en électrons donnent des paires d'électrons solitaires à une espèce chimique déficiente en électrons tels que les atomes métalliques chargés positivement. Lorsque les ligands et les cations se lient de cette manière, un composé de coordination est formé. L'atome à laquelle les ligands sont liés est appelé le centre de coordination.
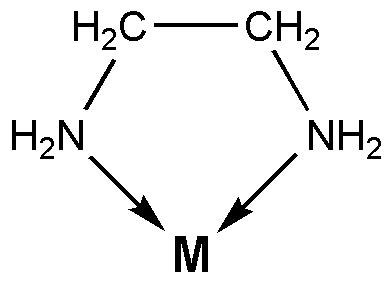
Figure 01: L'éthylènediamine est un ligand bidenté
Un ligand bidenté a deux atomes de donneurs. Cela signifie qu'il y a deux atomes qui peuvent donner leurs paires d'électrons solitaires. Certains exemples courants pour les ligands bidentés comprennent l'ion oxalate (c2O42-) qui a deux atomes d'oxygène comme atomes donneurs et l'éthylènediamine (C₂H₄ (NH₂) ₂) qui a deux atomes d'azote comme atomes donneurs.
Que sont les ligands ambidents?
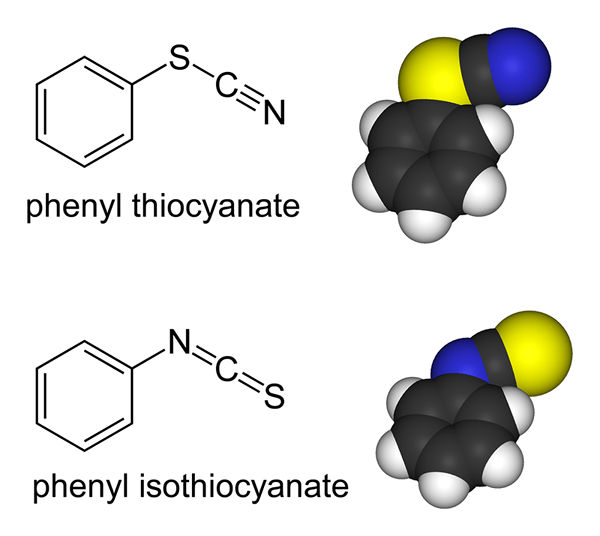
Les ligands ambidents sont des molécules ou des ions qui ont deux atomes de donneurs mais sont capables de se lier avec un atome via un seul atome de donneur à la fois. Des exemples de ligands ambidenés comprennent l'ion thiocyanate (SCN-) dans lequel l'atome de soufre et un atome d'azote sont capables de donner des paires d'électrons solitaires. Mais l'atome de soufre ou l'atome d'azote peuvent se lier au centre de coordination à la fois.

Figure 02: Le thiocyanate est un ligand ambidenat
Un autre exemple est l'ion nitrate (non2-) dans lequel l'atome d'azote et l'atome d'oxygène peuvent devenir un atome donneur.
Quelles sont les similitudes entre les ligands bidentés et ambidents?
- Les ligands bidentés et ambidents ont deux atomes de donneurs.
- Les deux ligands ont au moins deux atomes avec des paires d'électrons solitaires.
Quelle est la différence entre les ligands bidentés et ambidents?
Bidenter vs ambidenate ligands | |
| Les ligands bidentés sont des molécules ou des anions qui peuvent se lier à un atome via deux liaisons covalentes de coordonnées. | Les ligands ambidents sont des molécules ou des ions qui ont deux atomes de donneurs mais sont capables de se lier avec un atome via un seul atome de donneur à la fois. |
| Formation d'obligations | |
| Les ligands bidentés sont capables de former deux liaisons covalentes coordonnées à la fois. | Les ligands ambidents sont capables de former une liaison covalente coordonnée à la fois. |
| Exemples | |
| Des exemples de ligands bidentés comprennent l'éthylènediamine et l'ion oxalate. | Des exemples de ligands ambidents comprennent l'ion thiocyanate et l'ion nitrate. |
Résumé - Bidenter vs Ambidente Ligands
Les ligands sont des molécules ou des ions qui peuvent se lier aux atomes déficients en fonction des électrons via des liaisons covalentes coordonnées. Les ligands bidentés et les ligands ambidents sont ces deux formes de ligands. La différence entre les ligands bidentés et ambidenate est que les ligands bidentés peuvent se lier avec un atome central via deux liaisons en même temps tandis que les ligands ambidents sont capables de former deux liais.
Référence:
1. «Ligands | Types de ligands | Ligand de chélate, denticité, ligand ambidenate | Chimie | Byju's.”Chemistry, Byjus Classes, 8 mars. 2018. Disponible ici
2. LibreTexts. «Ligands.”Chemistry LibreTexts, LibreTexts, 19 janvier. 2018. Disponible ici
Image gracieuseté:
1.'M-en1'by Aucun auteur lisible par machine fourni (domaine public) via Commons Wikimedia
2.«PHSCN-PHNCS-COMPARISON» (Domaine public) via Commons Wikimedia


