Différence entre le benzène et le phényle
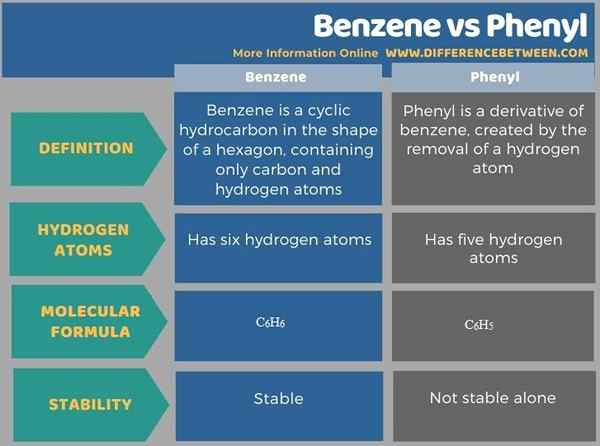
Le différence clé entre le benzène et le phényle est que Le benzène est un hydrocarbure cyclique en forme d'un hexagone, ne contenant que des atomes de carbone et d'hydrogène, tandis que le phényle est un dérivé du benzène, créé par l'élimination d'un atome d'hydrogène. Par conséquent, le benzène contient six atomes d'hydrogène tandis que le phényle contient cinq atomes d'hydrogène.
Le benzène est l'hydrocarbure aromatique les plus simples et sert de composé parent à de nombreux composés aromatiques importants. Le phényle est une molécule d'hydrocarbure avec la formule C6H5. Il s'agit en fait d'un dérivé du benzène et a donc des propriétés similaires à celle du benzène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le benzène
3. Qu'est-ce que le phényle
4. Comparaison côte à côte - benzène vs phényle sous forme tabulaire
5. Résumé
Qu'est-ce que le benzène?
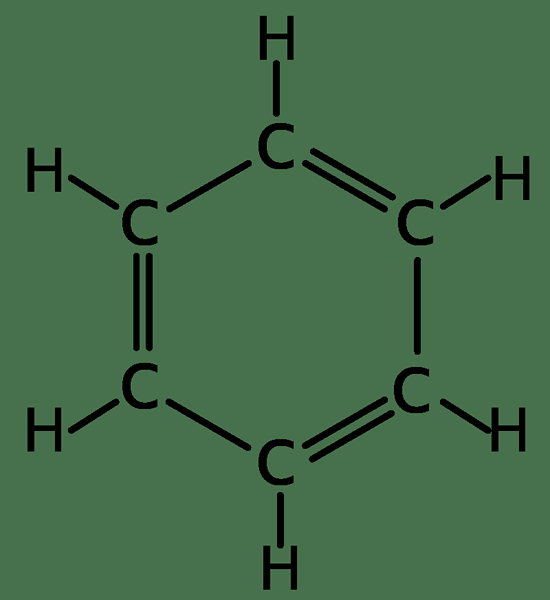
Le benzène n'a que des atomes de carbone et d'hydrogène disposés pour donner une structure planaire. Il a la formule moléculaire de C6H6. La structure de benzène a été trouvée par Kekule en 1872. En raison de l'aromaticité, elle est différente des composés aliphatiques.

Sa structure et certaines des propriétés sont les suivantes.
Poids moléculaire: 78 g mole-1
Point d'ébullition: 80.1 oC
Point de fusion: 5.5 oC
Densité: 0.8765 g cm-3
Le benzène est un liquide incolore avec une odeur douce. Il est inflammable et s'évapore rapidement lorsqu'il est exposé. Le benzène est utilisé comme solvant car il peut dissoudre de nombreux composés non polaires. Cependant, le benzène est légèrement soluble dans l'eau. La structure du benzène est unique par rapport aux autres hydrocarbures aliphatiques; Par conséquent, le benzène a des propriétés uniques.
Tous les carbones du benzène ont trois sp2 orbitales hybrides. Deux orbitales hybrides SP2 d'un chevauchement de carbone avec SP2 orbitales hybrides de carbones adjacents de chaque côté. Autre sp2 L'orbital hybridé chevauche l'orbital s de l'hydrogène pour former une liaison σ. Les électrons en orbitales p d'un carbone se chevauchent avec les électrons p des atomes de carbone dans les deux côtés, formant des liaisons Pi. Ce chevauchement d'électrons se produit dans les six atomes de carbone et produit par conséquent un système de liaisons Pi, qui sont réparties sur toute la bague de carbone. Ainsi, ces électrons seraient délocalisés. La délocalisation des électrons signifie qu'il n'y a pas de liaisons doubles et simples alternées. Par conséquent, toutes les longueurs de liaison C-C sont les mêmes, et la longueur est entre les longueurs de liaison simple et double. Étant donné que le cycle de benzène de délocalisation est stable, il hésite à subir des réactions d'addition, contrairement à d'autres alcènes.
Qu'est-ce que le phényle?
Le phényle est une molécule d'hydrocarbure avec la formule C6H5. Ceci est dérivé du benzène; Par conséquent, il a des propriétés similaires à celle du benzène. Cependant, cela diffère du benzène en raison de l'absence d'atome d'hydrogène dans un carbone. Par conséquent, le poids moléculaire du phényle est de 77 g mole-1. Le phényle est abrégé sous forme de pH. Habituellement, le phényle est attaché à un autre groupe phényle, atome ou molécule (cette partie est connue sous le nom de substituant).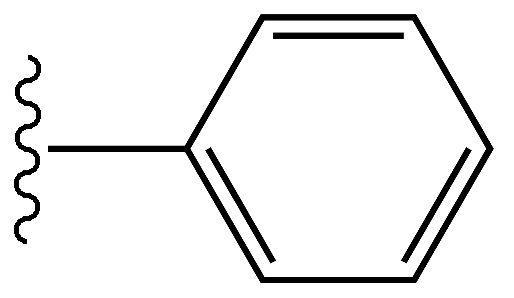
Les atomes de carbone du phényle sont SP2 hybridé comme en benzène. Tous les carbones peuvent former trois obligations sigma. Deux des liaisons Sigma sont formées avec deux carbones adjacents afin qu'il donne naissance à une structure d'anneau. L'autre liaison sigma est formée avec un atome d'hydrogène. Cependant, dans un carbone dans le ring, la troisième liaison Sigma est formée avec un autre atome ou molécule plutôt qu'un atome d'hydrogène. Les électrons en orbitales P se chevauchent pour former le nuage d'électrons délocalisé. Par conséquent, le phényl a des longueurs de liaisons C-C similaires entre tous les carbones, indépendamment des liaisons simples et doubles alternées. Cette longueur de liaison C-C est d'environ 1.4 Å. L'anneau est planaire et a un angle 120o entre les liaisons autour d'un carbone.
En raison du groupe substituant de phényle, la polarité et d'autres propriétés chimiques ou physiques changent. Si le substituant donne des électrons au nuage électronique délocalisé de l'anneau, ceux-ci sont appelés groupes d'électrons (e.g. -OCH3, NH2). Si le substituant attire des électrons du nuage d'électrons, il est connu comme un substituant à déchaînement d'électrons. (E.g. -No2, -cooh). Les groupes phényles sont stables en raison de leur aromaticité, ils ne subissent donc pas facilement d'oxydations ou de réductions. De plus, ils sont hydrophobes et non polaires.
Quelle est la différence entre le benzène et le phényle?
Fondamentalement, le phényl est dérivé du benzène. La principale différence entre le benzène et le phényle est que le benzène est un hydrocarbure cyclique en forme d'un hexagone, ne contenant que des atomes de carbone et d'hydrogène, tandis que le phényle est un dérivé du benzène, créé par l'élimination d'un atome d'hydrogène. De plus, la formule moléculaire du benzène est C6H6 Et, pour le phényle, c'est C6H5. Le phényle seul n'est pas aussi stable que le benzène.
Résumé - Benzène vs phényle
La principale différence entre le benzène et le phényle est que le benzène est un hydrocarbure cyclique en forme d'un hexagone, ne contenant que des atomes de carbone et d'hydrogène, tandis que le phényle est un dérivé du benzène, créé par l'élimination d'un atome d'hydrogène.
Image gracieuseté:
1. «Diagramme structurel du benzène» par Vladsinger - Propre travaux (domaine public) via Commons Wikimedia
2. «Phényl Radical Group» de Samuele Madini - propre travail (domaine public) via Commons Wikimedia