Différence entre l'auto-ionisation et l'autoprotolyse
Le différence clé entre l'auto-ionisation et l'autoprotolyse est que L'autoionisation est la conversion d'un état neutre d'une espèce chimique en un état ionisé tandis que l'autoprotolyse est le transfert d'un proton entre deux espèces chimiques identiques pour former des formes ionisées.
Les deux termes autoonisation et autoprotolyse décrivent les deux méthodes de formation d'espèces ionisées, i.e. cations et anions. Ce sont des réactions spontanées où l'ionisation se produit sans l'effet d'un facteur externe.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'auto-ionisation
3. Qu'est-ce que l'autoprotolyse
4. Comparaison côte à côte - autoonisation vs autoprotolyse sous forme tabulaire
5. Résumé
Qu'est-ce que l'auto-ionisation?
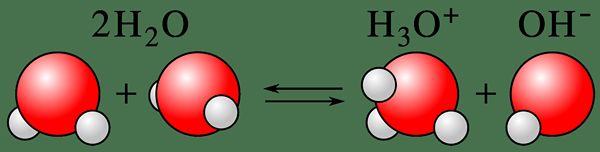
L'auto-ionisation est le processus de conversion d'un état neutre d'une espèce chimique en un état ionisé. Le terme décrit généralement l'ionisation des molécules d'eau. Par conséquent, nous pouvons l'appeler soit l'auto-ionisation de l'eau ou l'auto-dissociation de l'eau également. Ici, une molécule d'eau déprotonnez pour former un ion hydroxyde, OH- et un ion hydrogène, h+ (un proton). Ici, la déprotonation protona immédiatement une autre molécule d'eau et conduit à la formation d'un ion hydronium (H3O+). Ainsi, ce processus est un bon exemple de la nature amphotérique de l'eau.

Figure 01: auto-ionisation d'une molécule d'eau
De plus, ce processus décrit la nature amphotérique de l'eau. La nature amphotérique signifie que l'eau peut agir à la fois comme acide et base car l'auto-ionisation forme à la fois des protons et des ions d'hydroxyde, ce qui donne à l'eau la capacité de neutraliser les acides et les bases dans une petite mesure; par exemple, ion hydronium ou h3O+ L'ion peut neutraliser les bases légères et les ions hydroxyde peuvent neutraliser les acides légers.
Qu'est-ce que l'autoprotolyse?
L'autoprotolyse est le processus de transfert d'un proton entre des espèces chimiques identiques pour former des espèces ionisées. Ici, l'une des deux molécules identiques agit comme l'acide Brønsted, et il libère un proton. L'autre molécule peut accepter ce proton. Par conséquent, cette autre molécule agit comme la base de Brønsted. L'auto-ionisation de l'eau est un exemple d'autoprotolyse. De plus, ce terme est différent de l'autoprotonolyse car l'autoprotonolyse décrit le clivage d'une liaison chimique par les acides.
Certains autres exemples de composés chimiques qui subissent une autoprotolyse comprennent l'ammoniac et l'acide acétique;
Autoprotolyse de l'ammoniac:
2nh3 ⇌ NH2- + NH4+
Autoprotolyse de l'acide acétique:
2ch3COOH ⇌ CH3ROUCOULER- + Ch3COOH2+
Quelle est la différence entre l'auto-ionisation et l'autoprotolyse?
L'auto-ionisation et l'autoprotolyse sont des réactions spontanées. La principale différence entre l'auto-ionisation et l'autoprotolyse est que l'auto-ionisation est la conversion d'un état neutre d'une espèce chimique en un état ionisé tandis que l'autoprotolyse est le transfert d'un proton entre deux espèces chimiques identiques pour former des formes ionisées. Un exemple d'auto-ionisation est l'eau tandis que l'eau, l'ammoniac, l'acide acétique sont quelques exemples d'autoprotolyse.
De plus, dans le processus d'auto-ionisation (également connu sous le nom d'auto-ionisation de l'eau ou de l'auto-dissociation), une molécule d'eau déprotonne pour former un ion hydroxyde, OH- et un ion hydrogène, H + (un proton), tout en étant dans le processus de L'autoprotolyse, l'une des deux molécules identiques impliquées agit comme l'acide Brønsted et libère un proton qui est accepté par l'autre molécule qui agit comme la base de Brønsted. De plus, le processus d'auto-ionisation de l'eau décrit la nature amphotérique (il peut neutraliser à la fois des acides légers et des bases douces). D'un autre côté, l'autoprotolyse décrit la nature amphotérique des composés chimiques tels que l'eau, l'acide acétique et l'ammoniac.
L'infographie ci-dessous résume la différence entre l'auto-ionisation et l'autoprotolyse.
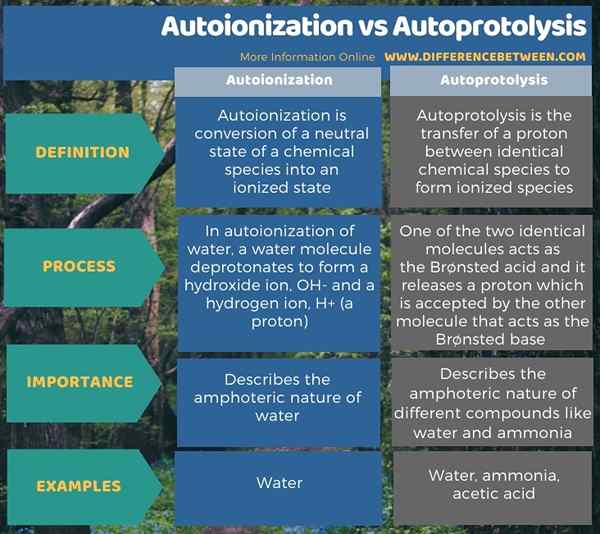
Résumé - Autoionisation vs autoprotolyse
L'auto-ionisation et l'autoprotolyse sont des réactions spontanées. La principale différence entre l'auto-ionisation et l'autoprotolyse est que l'auto-ionisation est la conversion d'un état neutre d'une espèce chimique en un état ionisé tandis que l'autoprotolyse est le transfert d'un proton entre deux espèces chimiques identiques pour former des formes ionisées.
Référence:
1. «Auto-ionisation de l'eau.»Wikipedia, Wikimedia Foundation, 3 juin 2019, disponible ici.
2. «Autoprotolyse.»Wikipedia, Wikimedia Foundation, 24 septembre. 2019, disponible ici.
3. «Autoionisation de l'eau.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
Image gracieuseté:
1. «Autoprotolyse Eau» de CDang - Propre travaux (domaine public) via Commons Wikimedia


