Différence entre ATPase et ATP synthase
Différence clé - ATPase vs ATP synthase
L'adénosine triphosphate (ATP) est une molécule organique complexe qui participe aux réactions biologiques. Il est connu comme «unité moléculaire de monnaie» de transfert d'énergie intracellulaire. On le trouve dans presque toutes les formes de vie. Dans le métabolisme, l'ATP est consommé ou généré. Lorsque l'ATP est consommée, l'énergie est libérée en convertissant en ADP (adénosine diphosphate) et AMP (adénosine monophosphate) respectivement. L'enzyme qui catalyse la réaction suivante est connue sous le nom d'ATPase.
ATP → ADP + PI + L'énergie est libérée
Dans d'autres réactions métaboliques qui incorporent l'énergie externe, l'ATP est généré à partir de l'ADP et de l'AMP. L'enzyme qui catalyse la réaction mentionnée ci-dessous est appelée ATP synthase.
ADP + PI → ATP + L'énergie est consommée
Alors le différence clé entre ATPase et ATP synthase est, L'ATPase est l'enzyme qui décompose les molécules d'ATP tandis que l'ATP synthase implique dans la production d'ATP.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que ATPase
3. Qu'est-ce que l'ATP Synthase
4. Similitudes entre ATPase et ATP synthase
5. Comparaison côte à côte - ATPase vs ATP synthase sous forme tabulaire
6. Résumé
Qu'est-ce que ATPase?
L'ATPase ou adénylpyrophosphatase (ATP Hydrolase) est l'enzyme qui décompose les molécules d'ATP en ADP et PI (ion phosphate libre). Cette réaction de décomposition libère l'énergie qui est utilisée par d'autres réactions chimiques dans la cellule. Les ATPases sont la classe des enzymes liées à la membrane. Ils se composent d'une classe différente de membres qui possèdent des fonctions uniques telles que NA+/ K+-ATPase, proton-ATPase, V-ATPase, hydrogène potassium-ATPase, F-ATPase et calcium-ATPase. Ces enzymes font partie intégrante des protéines transmembranaires. Les ATPases transmembranaires déplacent des solutés à travers la membrane biologique contre leur gradient de concentration généralement en consommant les molécules d'ATP. Ainsi, les principales fonctions des membres de la famille des enzymes ATPase déplacent les métabolites cellulaires à travers la membrane biologique et l'exportation de toxines, les déchets et les solutés qui peuvent entraver la fonction cellulaire normale.
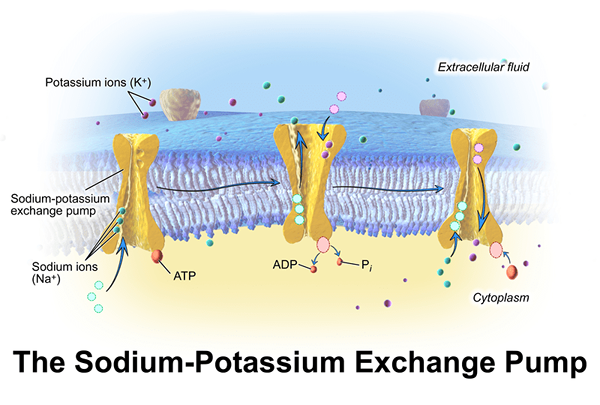
Un exemple très important est l'ATPase de l'échangeur de sodium / potassium (NA+/ K+-ATPase) qui implique le maintien du potentiel de la membrane cellulaire. L'hydrogène / potassium ATPase (H+/ P+-L'ATPase) acidule l'estomac qui est également connu sous le nom de «pompe à protons gastriques.«Certaines enzymes ATPase fonctionnent comme cotransporteurs et pompes. Le transport actif est le mouvement des molécules à travers une membrane d'une région de concentration plus faible à une région de concentration plus élevée de molécules contre un gradient de concentration. Le transport actif secondaire implique le gradient électrochimique. Les cotransporteurs sont utilisés dans le transport actif secondaire des molécules. Puis un+/ K+-L'ATPase est un cotransporteur bien connu qui provoque le flux net de charge.

Figure 01: ATPase (pompe sodium-potassium)
Classification ATPase
Il y a différents ATPases. Ils diffèrent en fonction, en structure et en ions qu'ils transportent. Les ATPases sont classées comme ci-dessous,
- F-ATPASE - Il se trouve dans les membranes plasmiques bactériennes, les mitochondries et le chloroplaste. La partie soluble dans l'eau de f1 Section Hydrolyse ATP.
- V-ATPase - On le trouve dans les vacuoles eucaryotes. Il catalyse l'hydrolyzage ATP dans les organites comme la pompe à protons de lysosome pour transporter des solutés.
- A-ATPase - Archaea a A-ATPase. Ils fonctionnent comme F-ATPase.
- P-ATPase - Il se trouve dans les bactéries, les champignons et les membranes et organites eucaryotes. Il fonctionne comme des transporteurs d'ions à travers la membrane.
- E-ATPase - Une enzyme de surface cellulaire implique l'hydrolyzage des NTPs, y compris l'ATP extracellulaire.
Qu'est-ce que l'ATP Synthase?
Ceci est l'enzyme qui crée l'ATP (molécules de stockage d'énergie). La réaction globale que le catalyse de la synthèse de l'ATP est aussi ci-dessous,
Adp + pi + h+ (Out) ⇌ ATP + H20 + H+ (dans)
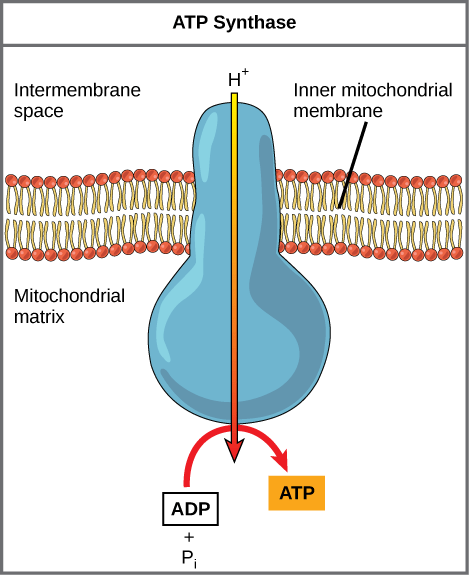
Figure 02: ATP synthase
Comme cette réaction est énergiquement défavorable (ATP de l'ADP), elle a lieu dans la direction inverse. Il a deux régions majeures dans la structure enzymatique. Cela a une structure motrice en rotation permettant la production d'ATP. Ce sont la région F1 (fraction 1) et F0 (fraction zéro) région. En raison de ce mécanisme de rotation (machine moléculaire), le f0 la région entraîne la rotation de f1région. F0 La région a un anneau C et d'autres sous-unités comme A, B, D et F6. F1 La région a des sous-unités alpha, bêta, gamma et delta. F1 et f0 Créez collectivement une voie pour le mouvement des protons à travers la membrane. Ils produisent principalement plus de molécules d'ATP dans la chaîne de transport d'électrons par la phosphorylation oxydative.
Quelles sont les similitudes entre ATPase et ATP synthase?
- Les deux régulent le nombre de molécules d'ATP dans la cellule.
- Les deux sont des enzymes multi-unités.
- Les deux peuvent réguler le mouvement des molécules à travers la membrane.
- Les deux sont des enzymes de poids moléculaire lourd.
- Les deux sont des enzymes qui sont de nature protéique.
Quelle est la différence entre l'ATPase et l'ATP synthase?
ATPase vs ATP Synthase | |
| L'ATPase est l'enzyme qui décompose les molécules d'ATP. | ATP synthase est l'enzyme qui implique la production d'ATP. |
| Réaction | |
| L'ATPase catalyse la réaction énergétiquement favorable (ATP à ADP). | ATP synthase catalyse la réaction énergétiquement défavorable (ADP à l'ATP). |
| Ion phosphate libre | |
| L'ATPase génère un ion phosphate libre. | ATP synthase consomme un ion phosphate libre pour produire de l'ATP. |
| Mécanisme de rotor moteur de la panne ATP | |
| ATPase ne montre pas le «mécanisme du rotor moteur» de la rupture ATP. | ATP synthase montre le «mécanisme du rotor moteur» de la production d'ATP. |
| Type de réaction | |
| L'ATPase est impliquée dans des réactions exothermiques. | L'ATP synthase est impliquée dans les réactions endothermiques. |
Résumé - ATPase vs ATP synthase
Les processus de production et d'hydrolyzation de l'ATP se trouvent dans presque toutes les formes de vie. Dans les réactions du métabolisme, soit ils sont consommés ou régénérés. Quand ils sont consommés, l'énergie est libérée. L'ADP (adénosine diphosphate) et AMP (adénosine monophosphate) sont produits pendant la rupture de l'ATP. L'enzyme catalysant la réaction de dégradation de l'ATP est connue sous le nom d'ATPase. Dans d'autres réactions métaboliques, l'ATP est généré à partir de l'ADP et de l'AMP. L'enzyme catalysant les réactions de production d'ATP est appelée ATP synthase. C'est la différence entre l'ATPase et l'ATP synthase.
Téléchargez la version PDF d'ATPase vs ATP Synthase
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici différence entre ATPase et ATP Synthase
Référence:
1.«ATPase.»Wikipedia, Wikimedia Foundation, 6 novembre. 2017, disponible ici
2.«ATP synthase.»Wikipedia, Wikimedia Foundation, 9 novembre. 2017, disponible ici
Image gracieuseté:
1.'Blausen 0818 Sodium-Potassiumpump'By Blausen.COM PERSONNEL (2014). «Médicale Galerie de Blausen Medical 2014». Wikijournal de médecine 1 (2). Doi: 10.15347 / WJM / 2014.010. ISSN 2002-4436. - Propre travail (CC par 3.0) via Commons Wikimedia
2.'Figure 07 04 02' par CNX OpenStax (CC par 4.0) via Commons Wikimedia


