Différence entre amphiprotique et amphotérique
Amphiprotique vs amphotérique
Comme l'amphiprotique et l'amphotérique sont assez similaires, la différence entre amphiprotique et amphotérique est également assez déroutante. Les deux termes, amphiprotiques et amphotériques, sont tous deux liés à la chimie acide-base. Les substances amphotériques se comportent comme un acide et comme une base. Toutes les substances amphiprotiques sont capables de faire un don et d'accepter des protons et peuvent montrer les propriétés d'acide et de base. Par conséquent, ils sont également amphotériques. Cet article décrit la différence entre les substances amphiprotiques et les substances amphotériques en détail. De plus, il donne des exemples et des réactions pour montrer leurs propriétés.
Que sont les substances amphiprotiques?
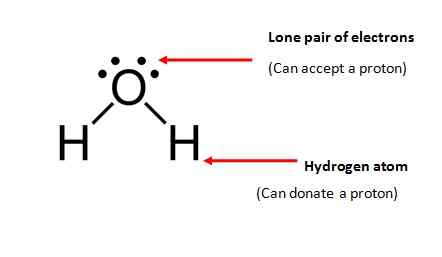
Le terme amphiprotique fait référence aux substances qui peuvent à la fois accepter et donner un proton; il peut être ionique ou covalent. Par conséquent, une substance amphotérique devrait avoir deux propriétés principales.
- La molécule doit contenir au moins un atome d'hydrogène et il peut être donné à une autre molécule.
- La molécule doit contenir une paire d'électrons solitaire (électrons qui ne sont pas impliqués dans la liaison chimique) pour accepter un proton.
Eau (h2O) est la plus courante des substances amphiprotiques; Une molécule d'eau satisfait aux deux exigences nécessaires pour une substance amphiprotique.

En plus de l'eau, la plupart des bases conjuguées des acides diprotiques peuvent agir comme des substances amphiprotiques.
Base conjuguée d'acide diprotique
H2DONC4 HSO4-
H2CO3 HCO3-
H2S HS-
H2Cro3 HCRO3-
Exemple: acide carbonique (h2CO3) est un acide diprotique faible, le bicarbonate (HCO3-) est sa base conjuguée. Dans des solutions aqueuses, le bicarbonate montre deux types de réactions.
(1) Donner un proton à l'eau (en tant que brronsted - acide lowry)
HCO3- (aq) + H2O -> H3O+ (aq) + CO32- (aq)
(2) Accepter un proton de l'eau (comme une base brronsted - Lowry)
HCO3- (aq) + H2O -> H2CO3 (aq) + OH- (aq)
Par conséquent, le bicarbonate (HCO3-) est une espèce amphiprotique.
Quelles sont les substances amphotériques?
Les substances qui peuvent agir à la fois comme l'acide et la base sont appelées substances amphotériques. Cette définition est assez similaire aux substances amphiprotiques. Parce que, toutes les substances amphiprotiques présentent des propriétés acides en donnant un proton et, de même, ils présentent des propriétés de base en acceptant un proton. Par conséquent, toutes les substances amphiprotiques peuvent être considérées comme amphotériques. Cependant, la déclaration inverse n'est pas toujours vraie.
Nous avons trois théories pour les acides et les bases:
Base théorique acide
Arrhenius H+ producteur oh- producteur
Bronsted-Lowry H+ donateur h+ acceptre
Lewis Electron Pair Acceptor Electron Pair Donor
Exemple: Al2O3 est un acide Lewis et une base de Lewis. Par conséquent, c'est une substance amphotérique, car elle ne contient pas de protons (H+), ce n'est pas une substance amphiprotique.
Al2O3 comme base:
Al2O3 + 6 HCl -> 2 Alcl3 + 3 h2O
Al2O3 comme un acide:
Al2O3 + 2naOH + 3 H2O -> Naal (OH)4
Quelle est la différence entre amphiprotique et amphotérique?
• Une substance amphiprotique se comporte comme un acide et comme une base. Une substance amphotérique peut accepter ou donner un proton (H+ ion).
• Toutes les substances amphotériques sont amphiprotiques, mais toutes les substances amphiprotiques ne sont pas amphotériques.
• Les espèces amphiprotiques considèrent la capacité de faire un don ou d'accepter un proton. Cependant, les espèces amphotériques considèrent la capacité d'agir comme un acide et comme une base. Les propriétés acides-base dépendent de trois facteurs, notamment la capacité de donner ou d'accepter un proton.
Si une substance possède une paire d'électrons à donner et qu'elle a la capacité d'accepter une paire d'électrons est considérée comme amphotérique.
Si une substance a la capacité de produire à la fois l'ion H +.
Résumé:
Amphiprotique vs amphotérique
Les substances amphotériques et amphiprotiques sont liées à la chimie acide-base. Ces deux substances présentent des propriétés d'acide et de base. En d'autres termes, ils peuvent réagir en tant qu'acide et comme une base en fonction des autres réactifs. Les substances amphiprotiques peuvent donner et accepter un proton. L'eau est l'exemple le plus courant pour une espèce amphiprotique. La plupart des bases conjuguées d'acides diprotiques également amphiprotiques. Les substances amphotériques peuvent se comporter comme un acide et comme une base.


