Différence entre l'ionisation et l'électrolyse
Le différence clé entre l'ionisation et l'électrolyse est que L'ionisation est la formation d'espèces chimiques ayant une charge électrique, tandis que l'électrolyse est le processus d'utilisation d'un courant électrique pour effectuer une réaction chimique non spontanée.
L'ionisation et l'électrolyse sont des processus très importants en chimie physique. Il existe différentes façons d'effectuer un processus d'ionisation. L'électrolyse peut également être utilisée pour ioniser les espèces chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ionisation
3. Qu'est-ce que l'électrolyse
4. Comparaison côte à côte - ionisation vs électrolyse sous forme tabulaire
5. Résumé
Qu'est-ce que l'ionisation?
L'ionisation est un processus chimique dans lequel les atomes ou les molécules obtiennent une charge positive ou négative. Il se produit en raison de l'élimination ou de l'obtention d'électrons à partir d'atomes ou de molécules, respectivement. Ici, les ions résultants sont nommés cations ou anions, selon la charge qu'ils ont, je.e. Les cations sont des ions chargés positivement et les anions sont des ions chargés négativement. Fondamentalement, la perte d'électrons d'un atome neutre ou une molécule forme un cation et le gain d'électrons d'un atome neutre lui donne une charge négative, formant un anion.
Lorsqu'un électron est retiré d'un atome gazeux neutre par addition d'énergie, il forme un cation monovalent. C'est parce qu'un atome neutre a un nombre égal d'électrons et de protons, ce qui n'a donné aucune charge nette; Lorsque nous retirons un électron de cet atome, il y a un excès de proton qui n'a pas d'électron pour neutraliser sa charge. Par conséquent, cet atome obtient une charge de +1 (c'est la charge du proton). La quantité d'énergie requise pour cela est la première énergie d'ionisation de cet atome.
En outre, l'ionisation qui se déroule dans une solution liquide est la formation d'ions dans la solution. Par exemple, lorsque les molécules HCl se dissolvent dans l'eau, les ions hydronium (H3O+) sont formés. Ici, le HCL réagit avec les molécules d'eau et forme des ions hydronium chargés positivement et du chlorure chargé négativement (CL-) ions.
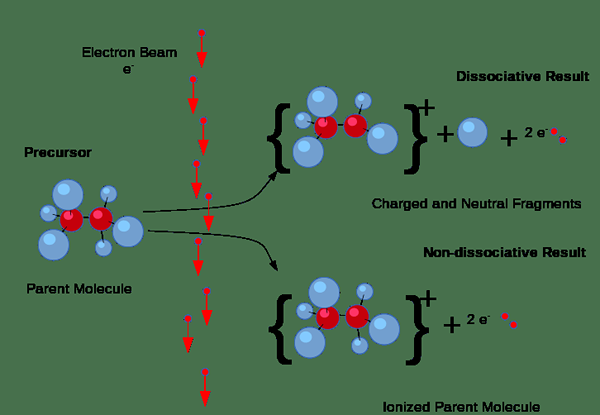
De plus, l'ionisation peut se produire par des collisions. Mais, ce type d'ionisation se produit principalement dans les gaz lorsqu'un courant électrique passe par le gaz. Si les électrons du courant ont une quantité suffisante d'énergie nécessaire pour éliminer les électrons des molécules de gaz, elles forceront les électrons des molécules de gaz, produisant des paires d'ions qui se composent de l'ion positif individuel et de l'électron négatif. Ici, les ions négatifs se forment également parce que certains électrons ont tendance à se fixer aux molécules de gaz plutôt que de retirer les électrons.
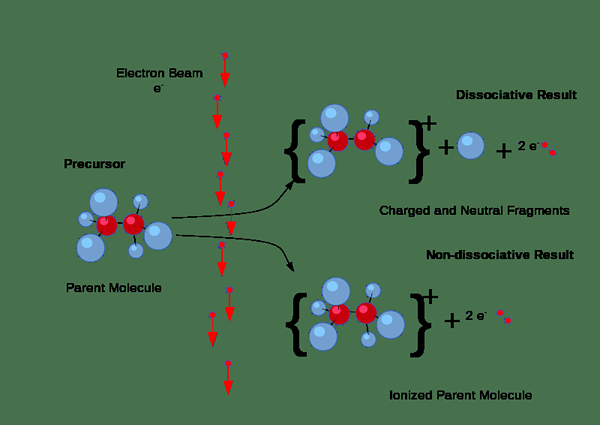
Figure 01: processus d'ionisation
De plus, l'ionisation se produit lorsque le rayonnement énergétique ou les particules chargées suffisamment énergiques passent à travers des solides, des liquides ou des gaz; Par exemple, les particules alpha, les particules bêta et le rayonnement gamma peuvent ioniser des substances; Par conséquent, nous les nommons comme un rayonnement ionisant.
Qu'est-ce que l'électrolyse?
L'électrolyse est le processus d'utilisation d'un courant électrique direct pour entraîner une réaction chimique non spontanée. Nous pouvons le faire en utilisant une cellule électrolytique. La technique de l'électrolyse est importante pour séparer un composé en ses ions ou autres composants.
En électrolyse, un courant électrique passe par une solution pour la mobilité des ions dans cette solution. Une cellule électrolytique contient deux électrodes immergées dans la même solution. Et, cette solution est l'électrolyte. Un facteur essentiel dans la régulation de la cellule électrolytique est «sur le potentiel». Nous devons fournir une tension plus élevée afin d'effectuer une réaction non spontanée. Ici, une électrode inerte peut également être utilisée pour fournir la surface de la réaction qui se produit.
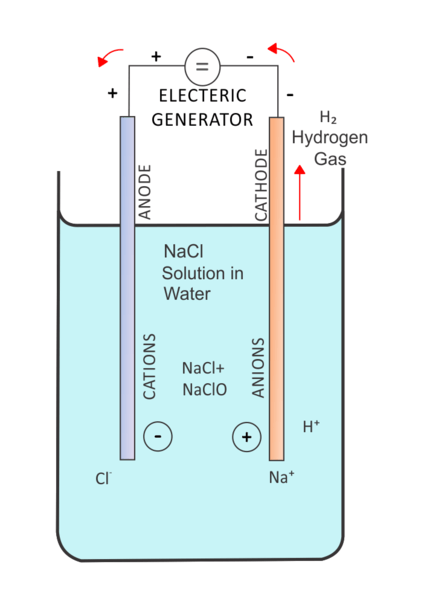
Figure 02: Electrolyse d'une solution saline
Il existe de nombreuses applications d'électrolyse. Une application courante est l'électrolyse de l'eau. Ici, l'eau est l'électrolyte. Ensuite, la réaction de la dégradation des molécules d'eau en hydrogène et en oxygène est effectuée en utilisant le courant électrique qui est passé à travers l'électrolyte.
Quelle est la différence entre l'ionisation et l'électrolyse?
L'ionisation et l'électrolyse sont des processus très importants en chimie physique. La principale différence entre l'ionisation et l'électrolyse est que l'ionisation est la formation d'espèces chimiques ayant une charge électrique, tandis que l'électrolyse est le processus d'utilisation d'un courant électrique pour effectuer une réaction chimique non spontanée.
Lorsque l'on considère le processus, l'ionisation peut avoir lieu pour plusieurs raisons telles que la réaction entre une espèce neutre et un agent ionisant, due aux collisions, en raison du rayonnement ionisant, etc. Cependant, toutes ces méthodes conduisent à l'élimination ou à l'ajout d'électrons aux composants chimiques, je.e. Le retrait d'un électron forme un cation et gagner un électron forme un anion. L'électrolyse est également une méthode que nous pouvons utiliser pour l'ionisation des composés. Donc, c'est une autre différence entre l'ionisation et l'électrolyse.

Résumé - ionisation vs électrolyse
L'ionisation et l'électrolyse sont des processus très importants en chimie physique. La principale différence entre l'ionisation et l'électrolyse est que l'ionisation est la formation d'espèces chimiques ayant une charge électrique, tandis que l'électrolyse est le processus d'utilisation d'un courant électrique pour effectuer une réaction chimique non spontanée.
Référence:
1. Helmenstine, Anne Marie. «Définition de l'électrolyse en chimie."Thoughtco, février. 7, 2019, disponible ici.
Image gracieuseté:
1. «Ionisation électronique» par Evan Mason - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Electrolyse de sel» par Sarah.Blumen - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


