Différence entre le nitrate d'ammonium et l'urée

Nitrate d'ammonium vs urée
Les composés contenant de l'azote sont couramment utilisés comme engrais car l'azote est l'un des éléments très essentiels pour la croissance et le développement des plantes. Le nitrate d'ammonium et l'urée sont de tels solides contenant de l'azote.
Nitrate d'ammonium
Le nitrate d'ammonium a la formule chimique de NH4NON3. C'est le nitrate de l'ammoniac, et il a la structure suivante.
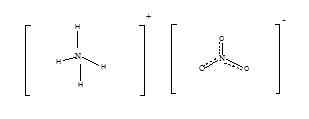
À température ambiante et la pression standard, le nitrate d'ammonium existe comme un solide cristallin blanc inodore. C'est un sel acide avec un pH d'environ 5.4. Sa masse molaire est de 80.052 g / mol. Le point de fusion du nitrate d'ammonium est d'environ 170 ° C et il se décompose lorsqu'il est chauffé à environ 210 oC. Le nitrate d'ammonium est principalement utilisé à des fins agricoles. Il est riche en azote, il est donc utilisé comme engrais, pour fournir de l'azote aux plantes. Étant donné que son contact direct avec le produit chimique n'est pas dangereux et que la toxicité est moindre, il est bénéfique à utiliser comme engrais. De plus, le chauffage ou l'allumage provoque l'explosion du nitrate d'ammonium. Par conséquent, il est utilisé comme agent oxydant dans les explosifs. En raison de cette nature explosive, lors du stockage du nitrate d'ammonium, nous devons être très prudents. Le nitrate d'ammonium est stable, mais quand il est dans l'état fondu, le risque d'explosion est plus élevé. Le risque augmente en contact avec des matériaux oxydables tels que l'huile, le diesel, le papier, le chiffon ou la paille. La production de nitrate d'ammonium est une réaction chimique simple. Lorsque l'acide nitrique est réagi avec du liquide d'ammoniac, le nitrate d'ammonium sous forme de solution est produit. Industriellement, l'acide nitrique concentré et le gaz d'ammoniac sont utilisés pour la production. Comme il s'agit d'une réaction très exothermique et violente, il est difficile de le produire à grande échelle. Étant un sel, le nitrate d'ammonium est très soluble dans l'eau. Par conséquent, lorsqu'il est utilisé comme engrais peut être lavé et s'accumule dans des plans d'eau. Cela pourrait être une condition mortelle pour la vie aquatique.
Urée
L'urée a la formule moléculaire de CO (NH2)2 et la structure suivante.
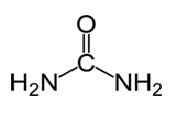
C'est un carbamide avec le groupe fonctionnel c = o. Deux NH2 Les groupes sont liés au carbone carbonyle de deux côtés. L'urée est naturellement produite chez les mammifères dans le métabolisme de l'azote. Ceci est connu sous le nom de cycle de l'urée, et l'oxydation de l'ammoniac ou des acides aminés produisent de l'urée à l'intérieur de notre corps. La majeure partie de l'urée est excrétée à travers des reins avec de l'urine alors que certains sont excrétés de sueur. La solubilité en eau haute de l'urée est utile lorsque. L'urée est un solide incolore et inodore, et il est non toxique. En plus d'être un produit métabolique, son utilisation principale est de produire des engrais. L'urée est l'une des engrais de libération d'azote les plus courantes, et il a une teneur élevée en azote par rapport à d'autres engrais azotés solides. Dans le sol, l'urée est convertie en ammoniac et en dioxyde de carbone. Cet ammoniac peut être converti en nitrite par les bactéries du sol. De plus, l'urée est utilisée pour produire des explosifs comme le nitrate d'urée. Il est également utilisé comme matière première pour produire des produits chimiques comme les plastiques et les adhésifs.
| Quelle est la différence entre Nitrate d'ammonium et urée? • La formule moléculaire du nitrate d'ammonium est NH4NON3. La formule moléculaire de l'urée est CO (NH2)2. • Le nitrate d'ammonium est un sel, alors que l'urée n'est pas. C'est un carbamide (molécule organique). • Une fois dissous dans l'eau, le nitrate d'ammonium produit une solution acide. En revanche, les solutions d'urée ne sont ni acides ni alcalines. |


