Différence entre le nitrate d'ammonium et le sulfate d'ammonium
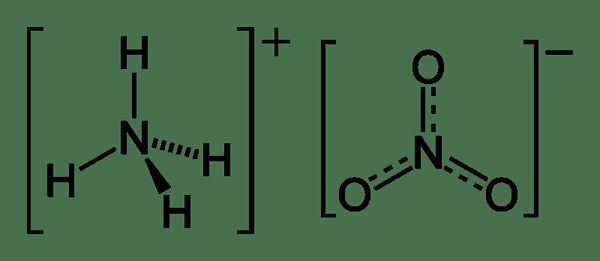
Le différence clé entre le nitrate d'ammonium et le sulfate d'ammonium est que Le nitrate d'ammonium est le résultat d'une réaction entre l'ammoniac et l'acide nitrique tandis que le sulfate d'ammonium est produit lorsque l'ammoniac réagit avec l'acide sulfurique. En outre, compte tenu de leur application principale en tant qu'engrais, le nitrate d'ammonium convient mieux aux sols acides tandis que le sulfate d'ammonium est mieux combiné les sols alcalins.
Le nitrate d'ammonium et le sulfate d'ammonium sont deux sels d'ammoniac qui est utile à diverses fins. De plus, le nitrate d'ammonium est également utile comme ingrédient dans les explosifs, mais sa principale utilisation est l'agriculture en tant qu'engrais. Le sulfate d'ammonium est également un sel inorganique d'ammoniac. C'est important comme engrais pour le sol. Voyons la différence entre les deux sels.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le nitrate d'ammonium
3. Qu'est-ce que le sulfate d'ammonium
4. Comparaison côte à côte - Nitrate d'ammonium vs sulfate d'ammonium sous forme tabulaire
6. Résumé
Qu'est-ce que le nitrate d'ammonium?
Le nitrate d'ammonium est un sel inorganique contenant un anion de nitrate lié à un cation ammonium. Par conséquent, nous pouvons le nommer comme un sel de nitrate de cation ammonium. La formule chimique de ce composé est NH4NON3. Ce composé existe comme un solide en cristal blanc qui est hautement soluble dans l'eau. Nous l'utilisons principalement à des fins agricoles comme engrais riche en azote. Une autre application majeure est son utilisation dans la production d'explosifs.
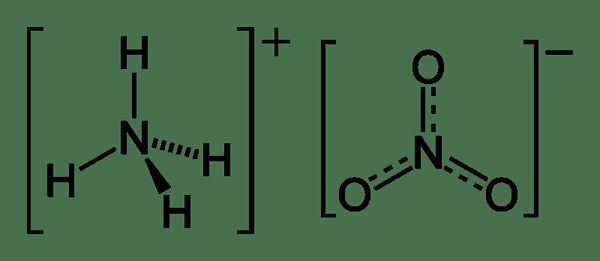
Figure O1: Structure chimique du nitrate d'ammonium
La masse molaire de ce composé est de 80.043 g / mol. Il apparaît comme un solide gris blanc. Le point de fusion de ce composé est 169.6 ° C, par conséquent, il se décompose au-dessus de 210 ° C. La dissolution de ce composé dans l'eau est endothermique. Lorsque vous envisagez l'occurrence, elle se produit comme un minéral naturel souvent en combinaison avec les minéraux halogénures. Dans le processus de production industrielle, nous pouvons utiliser une réaction acide-base entre l'ammoniac et l'acide nitrique afin de produire du nitrate d'ammonium. Là, nous devons utiliser l'ammoniac sous sa forme anhydre et l'acide nitrique sous sa forme concentrée.
Qu'est-ce que le sulfate d'ammonium?
Le sulfate d'ammonium est un composé inorganique contenant un cation d'ammonium lié à un anion de sulfate. La formule chimique de ce composé est (NH4)2DONC4. Par conséquent, il a deux cations d'ammonium par un anion sulfate. C'est un sel inorganique de sulfate avec de nombreuses utilisations importantes.
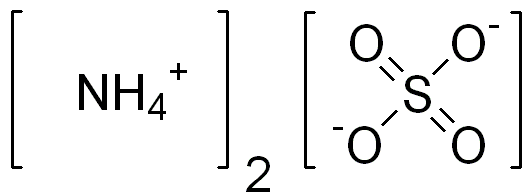
Figure O2: Structure chimique du sulfate d'ammonium
Sa masse molaire est de 132.14 g / mol; Ainsi, il apparaît comme des granules ou des cristaux hygroscopiques fins. De plus, le point de fusion varie de 235 à 280 ° C et au-dessus de cette plage de température, le composé se décompose. Nous pouvons produire ce composé en traitant de l'ammoniac avec de l'acide sulfurique. En cela, nous utilisons un mélange de gaz d'ammoniac et de vapeur d'eau dans un réacteur. Nous pouvons ajouter de l'acide sulfurique concentré dans ce réacteur. La réaction entre ces composants formera du sulfate d'ammonium.
Lorsque vous envisagez les utilisations de ce composé, nous pouvons l'utiliser comme engrais principalement pour les sols alcalins. De plus, nous pouvons l'utiliser dans la production d'insecticides, d'herbicides, de fongicides, etc. De plus, nous utilisons ce composé pour la purification des protéines via les précipitations dans le laboratoire de biochimie. Nous l'utilisons également comme additif alimentaire.
Quelle est la différence entre le nitrate d'ammonium et le sulfate d'ammonium?
Alors que le nitrate d'ammonium est le résultat d'une réaction entre l'ammoniac et l'acide nitrique, le sulfate d'ammonium est produit lorsque l'ammoniac réagit avec l'acide sulfurique. C'est la principale différence entre le nitrate d'ammonium et le sulfate d'ammonium. Malgré l'azote comme substance commune dans les deux sels, ils ont des propriétés physiques et chimiques différentes.
En raison des différences dans leurs propriétés, il y a une certaine différence entre le nitrate d'ammonium et le sulfate d'ammonium en application. Les ions sulfates dans le sulfate d'ammonium fonctionnent comme stimulant pour les sols alcalins. Ces ions aident à diminuer la valeur de pH du sol, ce qui le rend idéal pour la croissance des plantes. C'est pourquoi nous pouvons trouver que le sulfate d'ammonium est largement utilisé dans l'industrie des engrais. Le nitrate d'ammonium fonctionne également comme un engrais du sol. Il peut être saupoudré dans le sol comme un spray, ou on peut le vaporiser sous la forme de la poudre. Aussi, cela convient mieux aux sols acides. Il est donc prudent de faire vérifier la qualité de votre sol avant de finaliser l'un des deux engrais.
De plus, le nitrate d'ammonium est également utilisé comme des sacs froids car il libère de l'énergie exothermique lorsqu'elle est ajoutée à l'eau, ce qui rend le produit froid. En dehors de ce qui précède, il y a une autre utilisation du nitrate d'ammonium, et c'est comme un ingrédient actif dans les explosifs.
L'infographie ci-dessous présente plus de détails sur la différence entre le nitrate d'ammonium et le sulfate d'ammonium sous forme tabulaire.
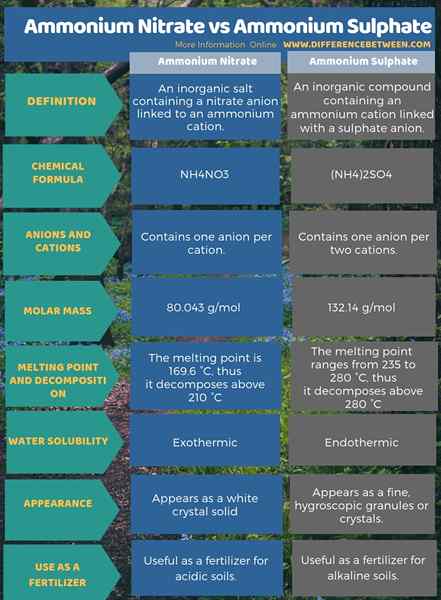
Résumé - Nitrate d'ammonium vs sulfate d'ammonium
Le nitrate d'ammonium et le sulfate d'ammonium sont utiles comme engrais. La principale différence entre le nitrate d'ammonium et le sulfate d'ammonium est que le nitrate d'ammonium est le résultat d'une réaction entre l'ammoniac et l'acide nitrique tandis que le sulfate d'ammonium est produit lorsque l'ammoniac réagit avec de l'acide sulfurique.
Référence:
1. "Nitrate d'ammonium.»Wikipedia, Wikimedia Foundation, 9 septembre. 2018. Disponible ici
Image gracieuseté:
1.«Ammonium-nitrate-2d» par Ben Mills - Propre travaux, (domaine public) via Commons Wikimedia
2.«Sulfate d'ammonium» par Edgar181 - Propre travaux, (domaine public) via Commons Wikimedia


