Différence entre l'ammoniac et l'ammonium
Le différence clé entre l'ammoniac et l'ammonium L'ammoniac est une molécule polaire non chargée existant comme un gaz à température ambiante, tandis que les ions d'ammonium sont chargés et existent sous forme d'ions libres en solution ou comme composés de sel cristallisé.
Il y a peu d'images et même certaines odeurs que nos esprits associent immédiatement à l'ammoniac ou à l'ammonium; Il s'agit notamment de ceux des engrais, des déchets azotés, des savons et même des explosifs. De plus, la plupart des gens supposent qu'il n'y a pas de différence entre l'ammoniac et l'ammonium. La forte similitude entre ces deux-là, et l'utilisation du mot ammoniac plus fréquemment comme terme général pour les composés d'ammoniac et d'ammonium purs est ce qui entraîne cette confusion.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ammoniac
3. Qu'est-ce que l'ammonium
4. Comparaison côte à côte - ammoniac vs ammonium sous forme tabulaire
5. Résumé
Qu'est-ce que l'ammoniac?
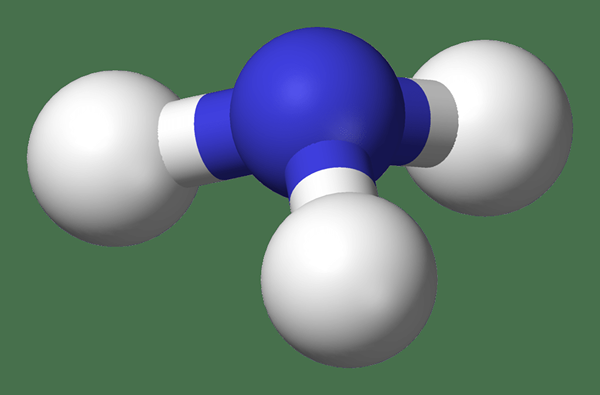
L'ammoniac est un composé d'azote et d'hydrogène avec la formule NH3. Il n'est pas chargé et une molécule en soi; Il existe en tant que gaz à température ambiante et à la pression atmosphérique, et comme un liquide à des températures très basses et des pressions élevées. Nous appelons cette forme pure d'ammoniac anhydre (sans eau) d'ammoniac. Le gaz de l'ammoniac est incolore et a une odeur nette et intensément irritante. De plus, c'est toxique.

Figure 01: molécule d'ammoniac
L'ammoniac, comme l'eau, est polaire en raison de sa distribution d'électrons inégale. Cette polarité le rend soluble dans l'eau. Un point important à noter est que l'ammoniac solubilisé ou aqueux est sous forme d'hydroxyde d'ammonium, qui se dissocie davantage pour former l'ion d'ammonium et l'ion hydroxyde. Cette dissociation dépend de la température et du pH de la solution (la dissociation augmente avec l'augmentation de la température et la diminution du pH).
Qu'est-ce que l'ammonium?
Le cation ammonium est un ion polyatomique chargé positivement avec la formule chimique NH4+. Il s'agit d'un ion qui pourrait exister sous forme d'ions libres dans des solutions, ou comme un composé de sel ionique formant une structure de réseau avec un anion; Par exemple, le chlorure d'ammonium.
Par conséquent, nous n'utilisons généralement pas le terme ammonium comme un mot en soi; Il précède toujours les mots «ion», le «sel» ou l'ion chargé négativement respectif. Par exemple, ce doit être l'ion ammonium, l'hydroxyde d'ammonium, le nitrate d'ammonium, le sulfate d'ammonium, etc., Et pas simplement l'ammonium.
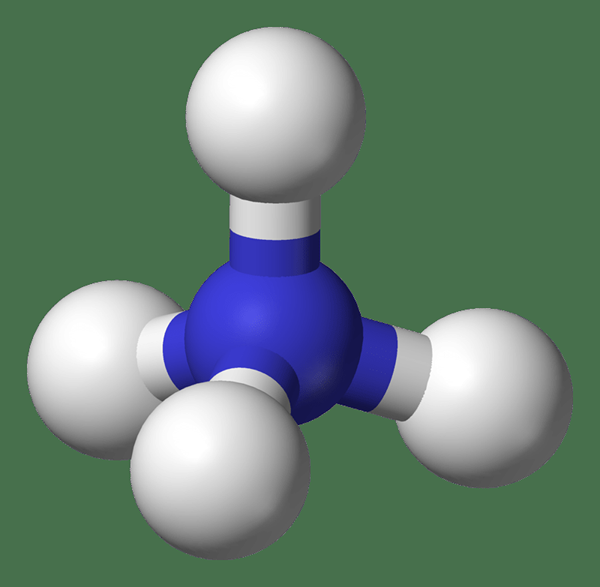
Figure 02: ion ammonium
Les ions ammonium n'ont pas d'odeurs caractéristiques; Cependant, les sels d'ammonium lorsqu'ils sont en solution aqueuse avec une dissociation lente, donnez des odeurs caractéristiques de l'ammoniac.
Quelle est la différence entre l'ammoniac et l'ammonium?
L'ammonium est le principal cation qui provient de l'ammoniac. La principale différence entre l'ammoniac et l'ammonium est que l'ammoniac est une molécule non chargée mais polaire existant comme un gaz à température ambiante, tandis que les ions d'ammonium sont chargés et existent sous forme d'ions libres en solution ou comme composés de sel cristallisé. De plus, l'ammoniac a une odeur nette et intensément irritante tandis que l'ion ammonium lui-même n'a pas d'odeur caractéristique.
Lorsque l'on considère la toxicité, l'ammoniac est toxique mais les ions d'ammonium libres ne sont pas en eux-mêmes. Cependant, les composés de l'ammonium peuvent être toxiques. De plus, l'ammoniac a un ensemble de caractéristiques en soi, mais les caractéristiques des composés d'ammonium dépendent également de l'anion associé.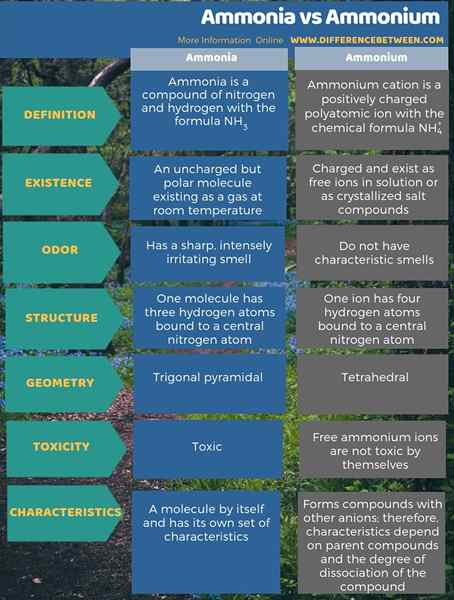
Résumé - Ammoniac vs ammonium
En bref, l'ammonium est le principal cation qui provient de l'ammoniac. La principale différence entre l'ammoniac et l'ammonium est que l'ammoniac est une molécule non chargée mais polaire existant comme un gaz à température ambiante, tandis que les ions d'ammonium sont chargés et existent sous forme d'ions libres en solution ou comme composés de sel cristallisé.
Référence:
1. «Étapes de processus de production d'ammoniac.»Ammoniac, pp. 65-176., doi: 10.1002/9783527613885.CH04.
Image gracieuseté:
1. «Ammoniac-3D-balls» (domaine public) via Commons Wikimedia
2. «Ammonium-3D-balls» (domaine public) via les communes Wikimedia


