Différence entre Alpha Helix et Beta Pleed Sheet
Différence clé - Alpha Helix vs Beta Pleeted Fheet
Les hélices alpha et les draps plissés bêta sont les deux structures secondaires les plus couramment trouvées dans une chaîne polypeptidique. Ces deux composants structurels sont les premières étapes principales du processus de pliage d'une chaîne polypeptidique. Le différence clé Entre Alpha Helix et la feuille plissée bêta est dans leur structure; Ils ont deux formes différentes pour faire un travail spécifique.
Qu'est-ce qu'Alpha Helix?
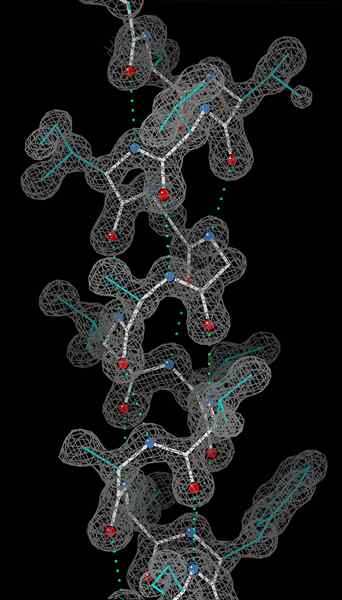
Une hélice alpha est une bobine droitier de résidus d'acides aminés sur une chaîne polypeptidique. La gamme de résidus d'acides aminés peut varier de 4 à 40 résidus. Les liaisons hydrogène formées entre l'oxygène du groupe C = O sur la bobine supérieure et l'hydrogène du groupe N-H de la bobine inférieure aident à maintenir la bobine ensemble. Une liaison hydrogène est formée pour quatre résidus d'acides aminés dans la chaîne de la manière ci-dessus. Ce motif uniforme lui donne des caractéristiques définies telles que l'épaisseur de la bobine et dicte la longueur de chaque virage complet le long de l'axe de l'hélice. La stabilité de la structure alpha hélice dépend de plusieurs facteurs.

O Atomes en rouge, n atomes en bleu et liaisons hydrogène comme lignes en pointillés verts
Qu'est-ce que la feuille plissée bêta?
La feuille bêta plissée, également connue sous le nom de feuille bêta, est considérée comme la deuxième forme de structure secondaire dans les protéines. Il contient des brins bêta qui sont connectés latéralement par un minimum de deux ou trois liaisons hydrogène de squelette pour former une feuille plissée torsadé comme indiqué dans l'image. Un brin bêta est un étirement de la chaîne polypeptidique; Sa longueur est généralement égale à 3 à 10 acides aminés, y compris le squelette dans une confirmation prolongée.
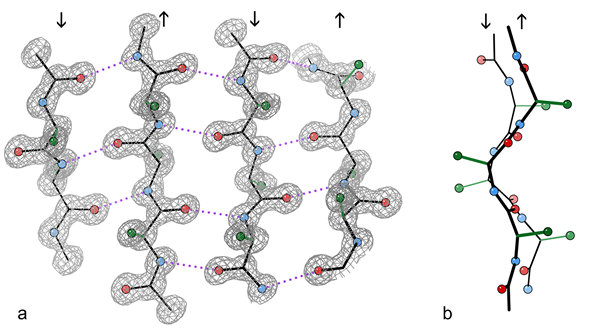
Fragment de feuille β antiparallèle 4 brin d'une structure cristalline de l'enzyme catalase.
a) montrant les liaisons hydrogène antiparallèles (pointillées) entre les groupes peptidiques NH et CO sur les brins adjacents. Les flèches indiquent la direction de la chaîne et les contours de la densité électronique décrivent les atomes non-H. O Les atomes sont des boules rouges, les atomes N sont bleus et les atomes H sont omis pour la simplicité; Les sidechains ne sont montrés que dans le premier atome C Sidechain C (vert)
b) Vue vers le bord des deux brins centraux β
Dans les draps bêta plissés, les chaînes polypeptidiques coulent les uns les autres. Il tire le nom de «feuille plissée» en raison de l'apparence en forme d'onde de la structure. Ils sont liés ensemble par des liaisons hydrogène. Cette structure permet de former plus de liaisons hydrogène en étirant la chaîne polypeptidique.
Quelle est la différence entre Alpha Helix et la feuille plissée bêta?
Structure de l'hélice alpha et de la feuille plissée bêta
Alpha Helix:
Dans cette structure, le squelette polypeptidique est étroitement lié autour d'un axe imaginaire comme structure en spirale. Il est également connu comme la disposition hélicoïdale de la chaîne peptidique.
La formation de la structure alpha hélice se produit lorsque les chaînes polypeptidiques sont tordues en spirale. Cela permet à tous les acides aminés de la chaîne de former des liaisons hydrogène (une liaison entre une molécule d'oxygène et une molécule d'hydrogène). Les liaisons hydrogène permettent à l'hélice de maintenir la forme en spirale et donne une bobine serrée. Cette forme en spirale rend l'hélice alpha très forte.
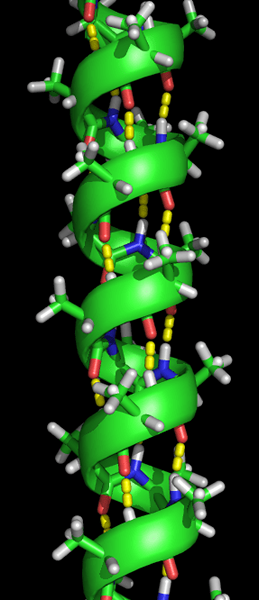
Les liaisons hydrogène sont indiquées par les points jaunes.
Feuille bêta plissée:
Lorsque deux ou plusieurs fragments de chaîne polypeptidique se chevauchent, formant une rangée de liaisons hydrogène entre elles, les structures suivantes peuvent être trouvées. Cela peut arriver de deux manières; arrangement parallèle et arrangement anti-parallèle.
Exemples de la structure:
Alpha Helix: Les ongles ou les ongles peuvent être pris comme un exemple de structure d'hélice alpha.
Feuille bêta plissée: La structure des plumes est similaire à la structure de la feuille plissée bêta.
Caractéristiques de la structure:
Alpha Helix: Dans Alpha Helix Structure, il y en a 3.6 acides aminés par tour de l'hélice. Toutes les liaisons peptidiques sont trans et planaires, et les groupes N-H dans les liaisons peptidiques pointent dans la même direction, qui est approximativement parallèle à l'axe de l'hélice. Les groupes C = O de toutes les liaisons peptidiques pointent dans la direction opposée, et ils sont parallèles à l'axe de l'hélice. Le groupe C = O de chaque liaison peptidique est lié au groupe N-H de la liaison peptidique formant une liaison hydrogène. Tous les groupes R sont pointés vers l'extérieur de l'hélice.
Feuille bêta plissée: Chaque liaison peptidique dans la feuille plissée bêta est planaire et a la transmission trans. Les groupes C = O et N-H de liaisons peptidiques à partir de chaînes adjacentes sont dans le même plan et pointent les unes vers les autres formant une liaison hydrogène entre eux. Tous les groupes R de n'importe quelle chaîne peuvent également se produire au-dessus et au-dessous du plan de la feuille.
Définitions:
Structure secondaire: c'est la forme d'une protéine pliante due à une liaison hydrogène entre ses groupes d'amide de squelette et de carbonyle.
Références: «Structure protéique». Chemwiki: la chimie dynamique hypertexte «Structure secondaire protéique: hélices α et feuilles β» . Protéinsstructures.com by Salam al Karadaghi «Chemistry organique». Le manuel de cellules virtuels «feuille bêta».Image Wikipedia gracieuseté: «Helix Electron Density Myoglobin 2nrl 17-32» par DCRJSR - Propre travaux (CC par 3.0) via les communes Wikimedia «Structure secondaire protéique» par EN: Utilisateur: Bikadi (CC BY-SA 3.0) via Commons Wikimedia «1gwe bêta antipar à la fois» par DCRJSR - PROPRE WORK (CC par 3.0) via Commons Wikimedia

