Différence entre alpha et hélice bêta

Le différence clé Entre Alpha et Beta Helix repose sur le type de liaison hydrogène qu'ils forment dans le développement de ces structures. Les hélices alpha forment des liaisons hydrogène intra-moléculaires tandis que les hélices bêta forment des liaisons hydrogène inter-moléculaires.
Les protéines complexes ont quatre niveaux organisationnels structurels - primaire, secondaire, tertiaire et quaternaire. Les structures secondaires des protéines forment les chaînes peptidiques dans différentes orientations. Les chaînes peptidiques sont constituées de séquences d'acides aminés liées par les liaisons peptidiques. Par conséquent, il existe deux structures secondaires principales dans les protéines comme Alpha Helix et Beta Helix. De plus, il existe d'autres structures secondaires appelées les structures en épingle bêta et en épingle. Surtout, cet article se concentre sur la différence entre Alpha et Beta Helix.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'Alpha Helix
3. Qu'est-ce que Beta Helix
4. Similitudes entre Alpha et Beta Helix
5. Comparaison côte à côte - Alpha vs Beta Helix sous forme tabulaire
6. Résumé
Qu'est-ce qu'Alpha Helix?
Les protéines ont quatre niveaux d'organisation structurels. Parmi ceux-ci, l'hélice alpha est la structure secondaire la plus courante des protéines. Et, cette structure apparaît comme une tige enroulée autour d'un axe central. De plus, l'hélice alpha est une hélice droite. Cependant, les hélices gauchers pourraient également être présentes. Ici, les liaisons peptidiques se forment de l'Amino-terminal au carboxy-terminal. Les acides aminés se lient entre eux via ces liaisons peptidiques. Les liaisons hydrogène intra-moléculaires sont la principale cause de la formation de l'hélice alpha.
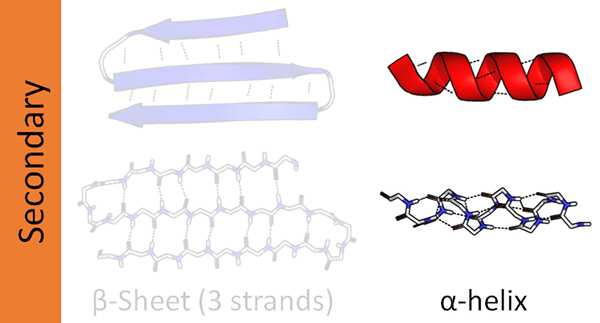
Figure 01: Alpha Helix
La disposition de l'hélice alpha dépend de la nature hydrophile et hydrophobe de la protéine. Si la séquence d'acides aminés se compose d'un nombre élevé de groupes R (variable) hydrophiles, les groupes R orientent vers la phase aqueuse. Si les groupes variables sont hydrophobes, ils se sont éloignés de la phase hydrophobe de l'environnement. Dans l'un ou l'autre scénario, les groupes R semblent s'étendre hors de la structure hélicoïdale. En raison de ces caractéristiques structurelles, Alpha Helix est plus résistante aux mutations. Ainsi, la présence de liaisons hydrogène stabilise la structure de l'hélice alpha. Il y a une moyenne de 3.6 résidus par tour dans une hélice alpha car il faut 3.6 résidus pour que les liaisons hydrogène se développent. Certaines protéines structurelles telles que le collagène et la kératine sont riches en hélices alpha.
Qu'est-ce que Beta Helix?
Une hélice bêta est la deuxième structure secondaire la plus courante d'une protéine. Bien qu'il ne soit pas aussi courant que l'hélice alpha, la présence d'hélices bêta joue également un rôle majeur dans la structure des protéines. La formation de l'hélice bêta se déroule via deux feuilles bêta disposées soit de manière parallèle, soit d'une manière anti-parallèle. Ces feuilles se forment alors dans une structure hélicoïdale. Les liaisons hydrogène inter-moléculaires entre deux brins de feuille aident à la formation d'une hélice bêta.

Figure 02: Beta Helix
Les hélices bêta peuvent être à la fois droites ou gauchers en fonction de leurs modèles de liaison. Lors de la formation d'une hélice bêta, les groupes variables des deux feuilles bêta s'organiseront dans le cœur de l'hélice. Par conséquent, la majorité des groupes formant des feuilles de bêta ont des fonctions hydrophobes.
Contrairement à l'hélice Alpha, 17 résidus forment un tour en hélices bêta. Les ions métalliques ont la capacité d'activer la formation de Beta Helix. Semblable à l'hélice alpha, les liaisons hydrogène soutiennent pour maintenir la structure de l'hélice bêta. L'enzyme de l'anhydrase carbonique et la lyase pectate sont deux protéines riches en hélices bêta.
Quelles sont les similitudes entre Alpha et Beta Helix?
- Alpha et Beta Helix sont deux structures secondaires de protéines.
- Les acides aminés sont les monomères des deux structures secondaires.
- De plus, les constituants chimiques des hélices alpha et bêta sont le carbone, l'hydrogène, l'oxygène, l'azote et le soufre.
- De plus, les deux structures secondaires deviennent une organisation de niveau supérieur.
- De plus, les deux sont stabilisés par des liaisons hydrogène.
- Dans les deux structures, l'hydrophobicité est déterminée par la présence des groupes R des acides aminés.
Quelle est la différence entre Alpha et Beta Helix?
La principale différence entre l'hélice alpha et bêta est le type de liaison hydrogène qu'ils montrent. Alpha Helix montre une liaison hydrogène intra-moléculaire tandis que Beta Helix montre une liaison hydrogène inter-moléculaire. De plus, l'hélice Alpha forme une hélice droite, tandis que Beta Helix peut former des hélices à droite et gaucher. Il s'agit donc également d'une différence significative entre Alpha et Beta Helix.
De plus, une autre différence entre l'hélice alpha et la bêta est que la formation d'hélice alpha se déroule par la torsion de la séquence d'acides aminés, tandis que dans la formation d'hélice bêta, les deux feuilles bêta parallèles ou anti-parallèles sont forcées à former la structure hélicoïdale.
L'info-graphique ci-dessous présente plus d'informations sur la différence entre Alpha et Beta Helix.
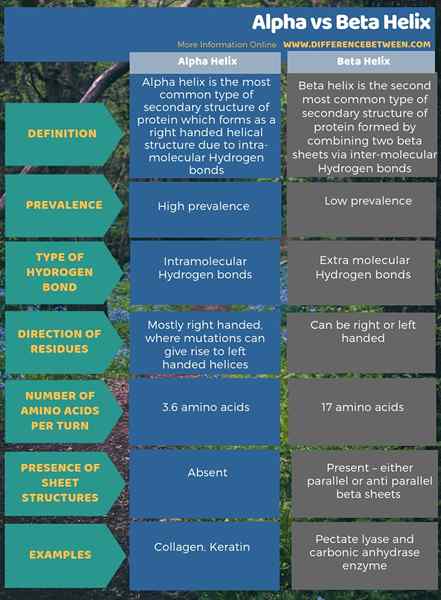
Résumé - Alpha vs Beta Helix
Les hélices alpha et les hélices bêta sont importantes pour identifier et déduire les structures de protéines complexes. Les deux types sont des structures secondaires de protéines. Cependant, Alpha Helix est une tournure hélicoïdale des séquences d'acides aminés. En revanche, la formation de l'hélice bêta se produit via la liaison hydrogène des feuilles bêta parallèles ou anti-parallèles. De plus, la liaison hydrogène est intra-moléculaire sous forme d'hélice alpha tandis que la liaison hydrogène est inter-moléculaire sous forme d'hélice bêta. En outre, ces deux structures ont un groupe R, qui détermine l'hydrophobicité de la protéine. Ainsi, cela résume la différence entre Alpha et Beta Helix.
Référence:
1. «Ordres de structure protéique.»Khan Academy, Khan Academy, disponible ici.
2. «Structure secondaire des protéines: hélices α et feuilles β.«Bioinformatique structurelle: guide pratique, disponible ici.
Image gracieuseté:
1. «Structure alpha bêta (2)» par Thomas Shafee - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «1m8n choristoneura fumiferana» de Willoww à la langue anglaise Wikipedia (CC By-Sa 3.0) via Commons Wikimedia


