Différence entre l'affinité et l'avidité
Différence clé - Affinité vs Avidité
L'interaction antigène des anticorps est une interaction cruciale dans les cellules pour réagir aux infections. Les antigènes sont les particules étrangères qui entrent dans les cellules hôtes. Ils sont principalement composés de polysaccharides ou de glycoprotéines et ont des formes particulières. L'interaction entre l'antigène et l'anticorps se produit en fonction de la liaison correcte des deux parties par les liaisons non covalentes telles que les liaisons hydrogène, les liaisons van der Waals, etc. Cette interaction est réversible. L'affinité et l'avidité sont deux paramètres qui mesurent la force de l'interaction antigène-anticorps dans l'immunologie. La principale différence entre l'affinité et l'avidité est que L'affinité est la mesure de la résistance de l'interaction individuelle entre un épitope et un site de liaison de l'anticorps tandis que l'avidité est la mesure des liaisons globales entre les déterminants antigéniques et les sites de liaison à l'antigène de l'anticorps multivalent. L'affinité est un facteur qui influence l'avidité de l'interaction des anticorps antigènes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'affinité
3. Qu'est-ce que l'avidité
4. Comparaison côte à côte - Affinité vs Avidité
5. Résumé
Qu'est-ce que l'affinité?
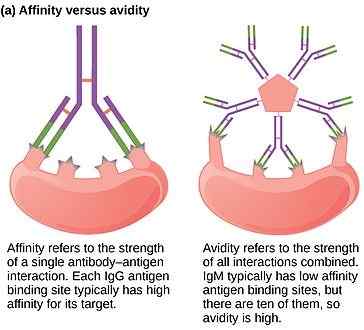
L'affinité est une mesure de l'interaction entre un site de liaison à l'antigène de l'anticorps et un épitope de l'antigène. La valeur d'affinité reflète le résultat net des forces attractives et répulsives entre l'épitope individuel et le site de liaison individuel. Une valeur d'affinité élevée est le résultat d'une forte interaction avec des forces plus attractives entre l'épitope et le site de liaison AB. Une faible valeur d'affinité indique le faible équilibre entre les forces attractives et répulsives.
L'affinité des anticorps monoclonaux peut être facilement mesurée car ils ont un seul épitope et sont homogènes. Les anticorps polyclonaux évaluent une valeur d'affinité moyenne en raison de leur nature hétérogène et de leurs différences dans les affinités envers les différents épitopes antigéniques.
Le test immunosorbant lié à l'enzyme (ELISA) est une nouvelle technique en pharmacologie qui est utilisée pour mesurer l'affinité des anticorps. Il en résulte des données plus précises, pratiques et informatives pour la détermination de l'affinité. Les anticorps d'affinité élevée se lient rapidement avec les épitopes et font un lien fort qui persiste pendant les tests immunologiques tandis que les anticorps à faible affinité dissolvent l'interaction et ne sont pas détectés par les tests.
Qu'est-ce que l'avidité?
L'avidité d'un anticorps est une mesure de la résistance globale de la liaison entre les antigènes et l'anticorps. Cela dépend de plusieurs facteurs tels que l'affinité de l'anticorps vers l'antigène, la valence de l'antigène et de l'anticorps et la disposition structurelle de l'interaction. Si l'anticorps et l'antigène sont multivalents et ont un arrangement structurel favorable, l'interaction reste très forte en raison d'une avidité élevée. Avidité montre toujours une valeur élevée que la sommation des affinités individuelles.
La plupart des antigènes sont multimériques et la plupart des anticorps sont multivales. Par conséquent, la plupart des interactions d'anticorps antigènes restent fortes et stables en raison d'une avidité élevée du complexe antigène-anticorps.

Figure01: Affinité et avidité d'un anticorps
Quelle est la différence entre l'affinité et l'avidité?
Affinité vs Avidité | |
| L'affinité fait référence à la force de l'interaction entre un épitope antigénique avec un site de liaison à l'antigène de l'anticorps. | L'avidité est la mesure de la force globale de l'interaction entre les épitopes antigéniques avec des anticorps multivalences. |
| Survenance | |
| Cela se produit entre l'épitope individuel et le site de liaison individuel | Cela se produit entre les antigènes multivalents et les anticorps. |
| Valeur | |
| L'affinité est l'équilibre des forces attractives et répulsives. | L'avidité peut considérer comme une valeur plus que la somme des affinités individuelles. |
Résumé - Affinité vs Avidité
L'interaction des anticorps antigènes est une interaction spécifique, réversible et non covalente importante dans les études immunologiques. Il est similaire à l'interaction du substrat enzymatique. L'antigène spécifique se lie à un anticorps spécifique. L'affinité et l'avidité sont deux mesures de cette interaction. L'affinité reflète la force d'une interaction entre un épitope et un site de liaison à l'antigène de l'anticorps. L'avidité reflète la force globale du complexe d'anticorps antigène. C'est la différence entre l'affinité et l'avidité. L'avidité est le résultat de multiples affinités qui se produisent dans un complexe d'anticorps antigène, car la plupart des antigènes et des anticorps sont multivalents et maintiennent plusieurs interactions pour stabiliser la liaison.
Les références:
1. Rudnick, Stephen I., et Gregory P. Adams. «Affinité et avidité dans le ciblage de tumeurs à base d'anticorps.»Biothérapie du cancer et radiopharmaceutiques. Mary Ann Liebert, Inc., Avr. 2009. la toile. 21 mars. 2017
2. Sennhauser, F. H., R. UN. MacDonald, D. M. Roberton et C. S. Hosking. «Comparaison de la concentration et de l'avidité d'anticorps spécifiques avec E. coli dans le lait maternel et le sérum.»Immunologie. U.S. Bibliothèque nationale de médecine, MAR. 1989. la toile. 22 mars. 2017
Image gracieuseté:
1. «Figure 42 03 04» par CNX OpenStax - (CC par 4.0) via Commons Wikimedia


