Différence entre l'adhésion et la cohésion

Le différence clé entre l'adhésion et la cohésion est que L'adhésion est l'attraction entre des substances ou des molécules qui ne sont pas similaires alors que la cohésion est l'attraction entre les molécules ou les substances qui sont similaires.
Il existe divers phénomènes pour expliquer les choses que nous observons dans notre vie quotidienne. Bien que parfois nous ne nous concentrons pas sur ces petits détails, ce sont ceux qui aident à garder la vie sur Terre. L'adhésion et la cohésion sont deux de ces phénomènes. Bien qu'ils semblent similaires, ce sont des termes complètement différents.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'adhérence
3. Qu'est-ce que la cohésion
4. Comparaison côte à côte - Adhésion vs cohésion sous forme tabulaire
5. Résumé
Qu'est-ce que l'adhérence?
L'adhésion est la force d'attraction entre deux types de molécules, qui sont différentes les unes des autres. Par exemple, l'attraction entre les molécules d'eau avec les murs des vaisseaux xylèmes est l'adhésion. En raison de cette force, l'eau peut traverser le xylème dans les plantes. De plus, ce sont des forces intermoléculaires.
Il y a cinq mécanismes pour expliquer le mécanisme d'adhésion comme suivi:
- Adhérence mécanique
- Adhérence chimique
- Adhérence dispersif
- Adhérence électrostatique
- Adhérence diffusif
Dans l'adhésion mécanique, le matériau adhésif maintient la surface en remplissant les trous ou les pores. Dans l'adhésion chimique, les liaisons chimiques se forment et elles peuvent être des liaisons ioniques ou covalentes. Si les liaisons sont ioniques, les électrons peuvent faire un don ou attirer, sinon le partage d'électrons peut être présenté dans une liaison covalente.
Autre que ceux-ci, les liaisons intermoléculaires comme les liaisons hydrogène peuvent participer à la maintien de deux matériaux ensemble. Si les deux matériaux sont maintenus ensemble en raison des forces de van der Waals, alors nous pouvons expliquer ce mécanisme par adhérence dispersif.
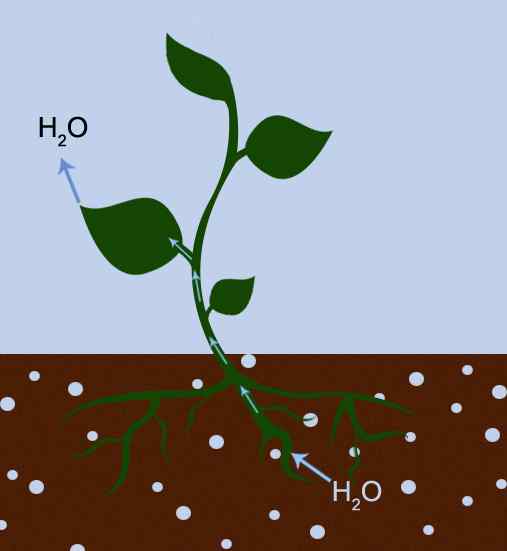
Figure 01: La transpiration est due à la fois à l'adhésion et à la cohésion
De plus, lorsqu'il y a une légère séparation de charges (permanente ou temporelle) dans une molécule, nous disons que la molécule est devenue polarisée. Les charges opposées ont tendance à s'attirer; Par conséquent, il existe des forces attractives entre les molécules. Un électron passant dans un matériau conducteur peut provoquer des différences de charge électrique. Les différences de charge peuvent provoquer des forces électrostatiques attrayantes entre les matériaux. Nous l'appelons l'adhésion électrostatique.
Lorsque deux types de molécules sont solubles l'un dans l'autre, ils peuvent se déplacer dans l'autre surface; Ainsi, cela entraîne une adhésion diffusive. La force des forces d'adhésion dépend du mécanisme; Quant à comment ça se passe. Par exemple, si la surface de contact est très plus grande, la force des forces de van der Waals est plus élevée. Par conséquent, la force des forces d'adhésion dispersives est plus élevée.
Qu'est-ce que la cohésion?
La cohésion est la force intermoléculaire entre deux molécules similaires. Par exemple, les molécules d'eau ont des forces d'attraction intermoléculaires entre elles. Cette propriété d'eau permet aux molécules d'eau de voyager avec cohérence. Nous pouvons expliquer la forme des gouttes de pluie ou l'existence de gouttelettes d'eau plutôt que de molécules uniques par la cohésion.

Figure 02: Formation de gouttes d'eau due à la cohésion
De plus, la capacité de liaison hydrogène des molécules d'eau est la principale raison derrière les forces de cohésion des molécules d'eau. Chaque molécule d'eau peut former quatre liaisons hydrogène avec d'autres molécules d'eau; Ainsi, la collection de forces d'attraction est beaucoup plus forte. Les forces électrostatiques et les forces de van der Waals entre des molécules similaires provoquent également l'adhésion. Cependant, l'adhésion due aux forces de van der Waals est quelque peu plus faible.
Quelle est la différence entre l'adhésion et la cohésion?
L'adhésion est la force d'attraction entre deux types de molécules, qui sont différentes l'une de l'autre et la cohésion est la force intermoléculaire entre deux molécules similaires. Par conséquent, la principale différence entre l'adhésion et la cohésion est que l'adhésion est l'attraction entre les substances ou les molécules qui ne sont pas similaires alors que la cohésion est l'attraction entre les molécules ou les substances similaires.
De plus, une autre différence significative entre l'adhésion et la cohésion est que l'adhésion comprend des attractions électrostatiques tandis que la cohésion inclut les forces de van der Waal et la liaison hydrogène. Par exemple, la cohésion se situe entre deux molécules d'eau et l'adhésion se situe entre les molécules d'eau et les murs des vaisseaux de xylème.

Résumé - Adhésion vs cohésion
L'adhésion et la cohésion sont deux types de forces intramoléculaires. La principale différence entre l'adhésion et la cohésion est que l'adhésion est l'attraction entre les molécules de substances qui ne sont pas similaires tandis que la cohésion est l'attraction entre les molécules ou les substances qui sont similaires.
Référence:
1. LibreTexts. «Forces cohésives et adhésives.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
Image gracieuseté:
1.”9897320755" par Zappys Technology Solutions (CC par 2.0) via Flickr
2.«Drops I» par Staffan Enbom de Finlande (CC par 2.0) via Commons Wikimedia


