Différence entre l'activité et la fugacité
Le différence clé entre l'activité et la fugacité est que L'activité fait référence à la concentration efficace d'une espèce chimique dans des conditions non idéales, tandis que la fugacité se réfère à la pression partielle efficace d'une espèce chimique dans des conditions non idéales.
L'activité et la fugacité sont des concepts chimiques importants dans la thermodynamique. Ces termes sont définis pour un comportement non idéal des gaz réels.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'activité
3. Qu'est-ce que la fugacité
4. Comparaison côte à côte - activité vs fugacité sous forme tabulaire
5. Résumé
Qu'est-ce que l'activité?
L'activité est la mesure de la concentration effective d'une espèce chimique sous comportement non idéal. Le concept d'activité a été conçu par le chimiste américain Gilbert N. Lewis. L'activité est une quantité sans dimension. La valeur de l'activité d'un composé particulier dépend de l'état standard de cette espèce. Par exemple, la valeur des substances en phases solides ou liquides est prise comme 1. Pour les gaz, l'activité fait référence à la pression partielle efficace, qui est la fugacité / pression du gaz que nous considérons. De plus, l'activité dépend des facteurs suivants:
- Température
- Pression
- Composition du mélange, etc.
Cela signifie; l'entourage affecte l'activité d'une espèce chimique. Les molécules de gaz dans des conditions non idéales ont tendance à interagir les unes avec les autres, soit s'attirant ou se repoussant. Par conséquent, l'activité d'une molécule ou d'un ion est affectée par les espèces chimiques présentes dans son environnement.
Qu'est-ce que la fugacité?
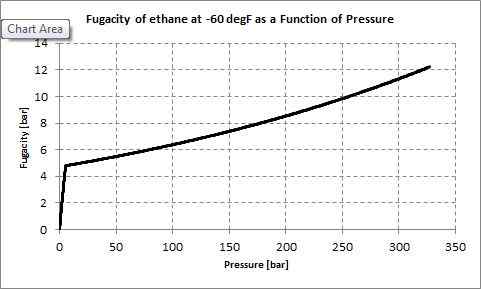
La fugacité est une mesure de la pression partielle efficace d'une espèce chimique dans des conditions non idéales. La valeur de la fugacité pour une espèce chimique particulière telle qu'un gaz réel est égale à la pression d'un gaz idéal qui a la température et l'énergie molaire Gibbs égale au gaz réel. Nous pouvons déterminer la fugacité en utilisant une méthode expérimentale ou en utilisant un autre modèle tel que Van der Waals Gas (qui est plus proche d'un réel gaz plutôt que d'un gaz idéal).
Le coefficient de fugacité est le lien entre la pression d'un gaz réel et sa fugacité. Nous pouvons le désigner en utilisant le symbole ϕ. La relation est,
ϕ = f / p
Ici, F est la fugacité, tandis que P est la pression du gaz réel. Pour un gaz idéal, les valeurs de pression et de fugacité sont égales. Par conséquent, le coefficient de fugacité pour un gaz idéal est 1.

Figure 01: Fugacité de l'éthane
En outre, ce concept de fugacité est étroitement lié à l'activité ou à l'activité thermodynamique. Nous pouvons donner cette relation, activité = fugacité / pression.
Quelle est la différence entre l'activité et la fugacité?
La principale différence entre l'activité et la fugacité est que l'activité fait référence à la concentration efficace d'une espèce chimique dans des conditions non idéales, tandis que la fugacité se réfère à la pression partielle efficace d'une espèce chimique dans des conditions non idéales. Par conséquent, dans le concept, l'activité thermodynamique est la concentration efficace de molécules réelles, i.e. gaz réels, tandis que la fugacité est la pression partielle efficace des gaz réels. De plus, nous pouvons déterminer la fugacité en utilisant une méthode expérimentale ou en utilisant un autre modèle tel que Van der Waals Gas (qui est plus proche d'un gaz réel plutôt que d'un gaz idéal), et cette valeur est égale à l'activité * de la pression du gaz réel.
L'infographie ci-dessous résume la différence entre l'activité et la fugacité.
Résumé - Activité vs fugacité
L'activité et la fugacité sont des concepts chimiques importants dans la thermodynamique. En résumé, la principale différence entre l'activité et la fugacité est que l'activité fait référence à la concentration efficace d'une espèce chimique dans des conditions non idéales, tandis que la fugacité se réfère à la pression partielle efficace d'une espèce chimique dans des conditions non idéales.
Référence:
1. Jones, Andrew Zimmerman. «Lois de la thermodynamique.”Thoughtco, sept. 7, 2019, disponible ici.
Image gracieuseté:
1. «Fugacité contre la pression de l'éthane à -60 degf» par Stieltjes - Excel Graph Utilisation de Peng-Robinson EOS (CC BY-SA 3.0) via Commons Wikimedia


