Différence entre le complexe activé et l'état de transition
Complexe activé vs état de transition | Complexe de transition vs complexe d'activation
Lorsqu'un ou plusieurs réactifs se convertissent en produits, ils peuvent passer par différentes modifications et changements d'énergie. Les liaisons chimiques dans les réactifs se brisent et de nouvelles liaisons se forment pour générer des produits, qui sont totalement différents des réactifs. Cette modification chimique est connue sous le nom de réactions chimiques. Il existe de nombreuses variables contrôlant les réactions. Pour qu'une réaction ait lieu, il devrait y avoir de l'énergie requise. Les molécules de réactifs passent par des changements tout au long de la réaction en supposant diverses configurations atomiques. Le complexe activé et l'état de transitions sont deux terminologies utilisées pour identifier ces complexes intermédiaires et la plupart du temps, ces deux termes sont utilisés de manière interchangeable.
Qu'est-ce que le complexe activé?
Une molécule doit être activée avant de pouvoir subir une réaction. Les molécules n'ont normalement pas beaucoup d'énergie avec elles, mais parfois certaines molécules sont dans un état d'énergie pour subir des réactions. Lorsqu'il y a deux réactifs, pour que la réaction se produise, les réactifs doivent entrer en collision les uns avec les autres dans l'orientation appropriée. Bien que les réactifs se rencontrent, la plupart des rencontres ne mènent pas à une réaction. Ces observations ont donné l'idée d'avoir une barrière d'énergie aux réactions. Les réactifs avec des états d'énergie plus élevés dans le mélange réactionnel peuvent être considérés comme des complexes activés. Tous les complexes activés ne peuvent pas aller aux produits, ils peuvent être retombés pour les réactifs s'ils n'ont pas assez d'énergie.
Qu'est-ce que l'état de transition?
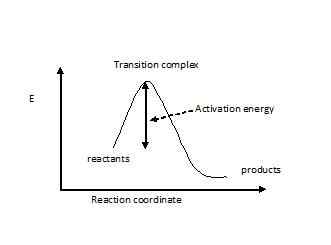
L'état de transition est pensé à celui dans lequel la molécule de réaction est tendu ou déformé ou a une configuration électronique défavorable. La molécule doit passer à travers cet état de transition à haute énergie avant que la réaction ne se produise. L'énergie est connue sous le nom d'énergie d'activation. C'est la barrière d'énergie la plus élevée pour une réaction. Si l'activation d'une réaction est trop élevée, seule une petite fraction de molécules aura suffisamment d'énergie pour la surmonter, de sorte que la concentration attendue des produits ne sera pas obtenue. La disposition atomique de toutes les molécules dans la réaction, qui a l'énergie d'activation, est appelée le complexe de transition. Le complexe de transition possède des composants avec des obligations partiellement cassées et de nouvelles obligations partiellement faites. Par conséquent, il a des charges négatives et positives partielles. L'état de transition est illustré avec un panneau à double dague (‡). Si l'énergie de l'état de transition d'une réaction peut être abaissée, la réaction doit être beaucoup plus rapide et nécessitera une faible énergie pour continuer. Pour une réaction exothermique, ce qui suit est la courbe d'énergie.
 Il est essentiel de connaître les structures de l'état de transition, en particulier lors de la conception des médicaments pour l'inhibition des enzymes.
Il est essentiel de connaître les structures de l'état de transition, en particulier lors de la conception des médicaments pour l'inhibition des enzymes.
|
Quelle est la différence entre le complexe activé et l'état de transition? • L'état de transition est la disposition atomique avec la plus grande énergie lorsque les réactifs vont aux produits. Les complexes activés sont toutes les autres configurations de la voie de réaction, qui ont une énergie plus élevée que les molécules normales. • Il y a une forte possibilité qu'un complexe d'État de transition se rende aux produits. Cependant, les complexes d'activation peuvent retomber pour former des réactifs que d'aller aux produits.
|


