Différence entre les actinides et les lanthanides
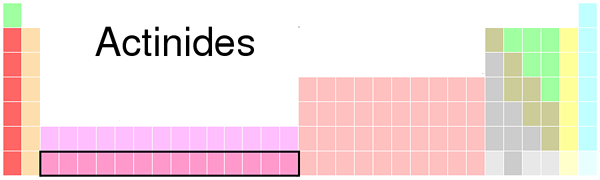
Le différence clé entre les actinides et les lanthanides est que le Les actinides remplissent les électrons aux sous-orbitales 5F, tandis que les lanthanides remplissent des électrons jusqu'à 4f sous-orbitales.
Les lanthanides et les actinides se produisent dans deux lignes distinctes dans le tableau périodique. Par conséquent, les deux appartiennent au bloc F. C'est parce qu'ils ont leurs électrons les plus externes en orbitales. Par conséquent, nous pouvons les nommer comme des éléments de bloc.
CONTENU
1. Aperçu et différence clé
2. Que sont les actinides
3. Que sont les lanthanides
4. Comparaison côte à côte - Actinides vs lanthanides sous forme tabulaire
5. Résumé
Que sont les actinides?
Actinides est un ensemble d'éléments du tableau périodique avec les nombres atomiques allant de 90 à 103. En conséquence, il y a 14 éléments métalliques, y compris les suivants:
- thorium th (z = 90)
- Protacinium PA (91)
- Uranium U (92)
- Neptunium NP (93)
- Plutonium PU (94)
- Americium AM (95)
- Curium CM (96)
- Berkelium BK (97)
- Californium CF (98)
- einsteinium es (99)
- Fermium FM (100)
- Mendelevium MD (101)
- une unité ї 102
- Lawrencium LR (103).
Nous les nommons comme des éléments de bloc F; Parce que leurs électrons finaux sont dans un sub-orbital F. Tous les actinides sont instables; Par conséquent, tous sont radioactifs. Puisqu'ils sont des métaux, ils sont hautement électropositifs. De plus, ce sont des métaux denses, et de nombreux allotropes sont présents. Ces métaux se ternissent facilement dans l'air et réagissent avec de l'eau bouillante ou de l'acide dilué libérant l'hydrogène gazeux.

Figure 01: Emplacement de l'actidide dans le tableau périodique
Comme d'autres métaux, ils peuvent également former des composés avec des éléments non métalliques. De plus, nous pouvons trouver des actinides dans l'environnement naturel, bien que certains soient très rares. Par exemple, l'uranium et le thorium sont présents comme des dépôts, au Canada. En raison de leur radioactivité, la plupart des actinides sont utiles dans la production d'énergie nucléaire. Nous pouvons produire des éléments d'actidide synthétiquement pour les utiliser à diverses fins. En dehors de cela, certains d'entre eux sont utiles à des fins médicinales, l'identification des minéraux, la radiographie à neutrons, etc.
Que sont les lanthanides?
Les lanthanides contiennent des éléments du numéro atomique 57 à 71. Il y a 15 éléments métalliques. Ces éléments incluent les suivants:
- Lanthanum LA (57)
- Cerium CE (58)
- Prasyodymium PR (59)
- Néodyme ND (60)
- Prométhium PM (61)
- Samarium SM (62)
- Europium EU (63)
- Gadolinium GD (64)
- Terbium TB (65)
- dysprosium dy (66)
- Holmium Ho (67)
- Yttrium ER (68)
- Thulium TM (69)
- ytterbium yb (70)
- Lutetium Lu (71).
Ceux-ci appartiennent au bloc F dans le tableau périodique; Par conséquent, les électrons finaux se remplissent dans le sous-orbital 4F. Là, d'autres sous-orbitales couvrent les orbitales 4F, et la chimie des lanthanides diffère en raison de la taille de l'atome. Ils montrent un état d'oxydation +3. De plus, de gauche à droite d'une rangée dans le tableau périodique, la taille des ions de lanthanure +3 diminue, et nous appelons cela comme une contraction du lanthanure.
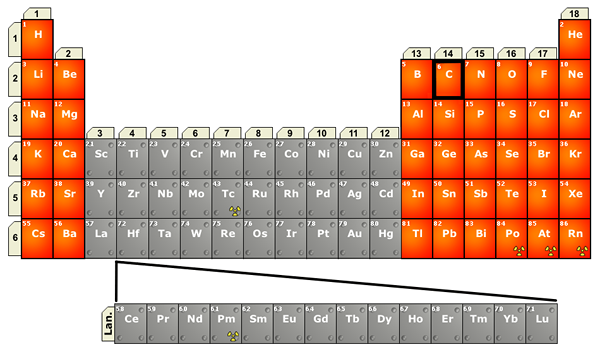
Figure 02: Emplacement des lanthanides dans le tableau périodique
De plus, les lanthanides sont des métaux de couleur argentée, qui réagissent facilement avec l'oxygène dans l'air pour produire leurs oxydes. Ce sont des métaux hautement réactifs et relativement doux avec des points de fusion élevés et des points d'ébullition. De plus, ils forment facilement des composés ioniques avec des non-métaux. Lors de la réaction avec de l'acide dilué ou de l'eau, les lanthanides produisent de l'hydrogène gazeux.
En dehors de cela, ces éléments ont des électrons non appariés (sauf lutetium), qui sont responsables de leurs propriétés paramagnétiques. De plus, nous les nommons comme des métaux de terres rares en raison de la faible abondance sur la surface de la Terre. Bien qu'ils soient rares, il y a beaucoup d'utilisations de ces éléments. Par conséquent, ils sont utiles comme catalyseurs dans la production de verre, le pétrole, etc. De plus, ils sont utiles dans les aimants, les phosphores, les lampes, les supraconducteurs, les applications optoélectroniques, etc.
Quelle est la différence entre les actinides et les lanthanides?
Actiides est un ensemble d'éléments du tableau périodique avec les nombres atomiques allant de 90 à 103 tandis que les lanthanides sont un ensemble d'éléments dans le tableau périodique avec des numéros atomiques 57 à 71. La principale différence entre les actinides et les lanthanides est que les actinides remplissent les électrons aux sous-orbitales 5F, tandis que les lanthanides remplissent des électrons jusqu'à 4f sous-orbitales. De plus, tous les actinides sont radioactifs, mais les lanthanides ne le sont pas (sauf le prométhium). En tant qu'une autre différence entre les actinides et les lanthanides, nous pouvons dire que les lanthanides montrent un état d'oxydation maximum +4 tandis que les actinides montrent +3, +4, +5, +6 et +7 états d'oxydation.
Ci-dessous infographie présente un résumé de comparaison de la différence entre les actinides et les lanthanides.

Résumé - Actinides vs lanthanides
Actiides est un ensemble d'éléments du tableau périodique avec les nombres atomiques allant de 90 à 103 tandis que les lanthanides sont un ensemble d'éléments dans le tableau périodique avec des numéros atomiques 57 à 71. Par conséquent, leur principale différence existe dans leur configuration d'électrons. Par conséquent, la principale différence entre les actinides et les lanthanides est que les actinides remplissent les électrons aux sous-orbitales 5F, tandis que les lanthanides remplissent les électrons jusqu'à 4f sous-orbitales.
Référence:
1. LibreTexts. «Lanthanides: propriétés et réactions.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
2. LibreTexts. «Les actinides.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Actinide-Table» (CC BY-SA 3.0) via Commons Wikimedia
2.«Orgchem Maingrp Metals of InterestDpsderived» par leprof 7272 - propre travail, (CC BY-SA 3.0) via Commons Wikimedia


