Différence entre le sel acide et le sel de base

Le différence clé entre le sel acide et le sel de base est que Les sels acides forment une solution inférieure à pH 7.0 Lorsqu'il est dissous dans l'eau, tandis que les sels de base forment une solution supérieure à PH 7.0 Lorsqu'il est dissous dans l'eau.
Un sel est un composé ionique qui contient un cation et un anion. C'est un composé solide qui n'a pas de charge nette car les cations et les anions se combinent entre eux de telle manière que la charge électrique des cations est équilibrée avec celle des anions. Selon la composition ionique d'un sel, les propriétés et la réactivité peuvent être déterminées. Par conséquent, nous pouvons classer un sel en trois groupes comme des sels acides, des sels de base et des sels neutres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un sel acide
3. Qu'est-ce qu'un sel de base
4. Comparaison côte à côte - sel acide vs sel de base sous forme tabulaire
5. Résumé
Qu'est-ce qu'un sel acide?
Les sels acides sont des composés ioniques qui peuvent former des solutions acides lors de la dissolution dans l'eau. Cela signifie; Le sel acide forme une solution aqueuse inférieure à pH 7.0. Cela se produit soit en raison de la présence d'un cation métallique qui peut réagir en tant qu'acide Lewis ou en raison de la présence de protons hydrolysables. Le plus souvent, les sels acides contiennent des protons hydrolysables. Ces protons hydrolysables peuvent exister dans le cation ou l'anion.
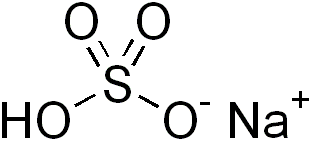
Figure 01: Le bisulfite de sodium est un sel acide
Protons hydrolysables en cation
Les sels acides qui contiennent des cations avec des protons hydrolysables sont principalement des ions d'ammonium. Les ions d'ammonium proviennent des sels d'ammonium. En outre, ces protons hydrolysables peuvent se produire dans des composés organiques qui contiennent des groupes amine protonés. E.g. ion ammonium, ion méthyl ammonium, ion éthyl ammonium, ion anilinium, etc.
Protons hydrolysables en anion
Les sels acides peuvent contenir les protons hydrolysables dans l'anion. Les exemples incluent l'ion bisulfite, le citrate de dihydrogène, l'ion bioxalate, etc. Ces anions contiennent des protons faiblement dissociés en eau.
Qu'est-ce qu'un sel de base?
Les sels de base sont des composés ioniques qui peuvent former des solutions de base lors de la dissolution dans l'eau. Cela signifie; Ces sels peuvent former une solution aqueuse avec un pH supérieur à 7.0. Généralement, un sel de base peut déprotone une molécule d'eau et former des ions hydroxyde qui peuvent provoquer la basicité dans la solution aqueuse.

Figure 02: Le sulfure de sodium est un sel de base
Certains exemples de sels de base comprennent le bicarbonate de sodium, le carbonate de calcium, l'acétate de sodium, le cyanure de potassium et le sulfure de sodium. Ces sels peuvent réagir avec l'eau, forçant les molécules d'eau à éliminer un ion hydroxyde.
Quelle est la différence entre le sel acide et le sel de base?
La principale différence entre le sel acide et le sel de base est que les sels acides forment une solution inférieure à pH 7.0 Lorsqu'il est dissous dans l'eau, tandis que les sels de base forment une solution supérieure à PH 7.0 Lorsqu'il est dissous dans l'eau. Les sels d'ammonium, le bisulfite de sodium et l'oxalate de calcium sont quelques exemples de sels acides, tandis que le bicarbonate de sodium, le carbonate de calcium, l'acétate de sodium, le cyanure de potassium et le sulfure de sodium sont quelques exemples de sels de base.
En dessous de l'infographie résume la différence entre le sel acide et le sel de base.
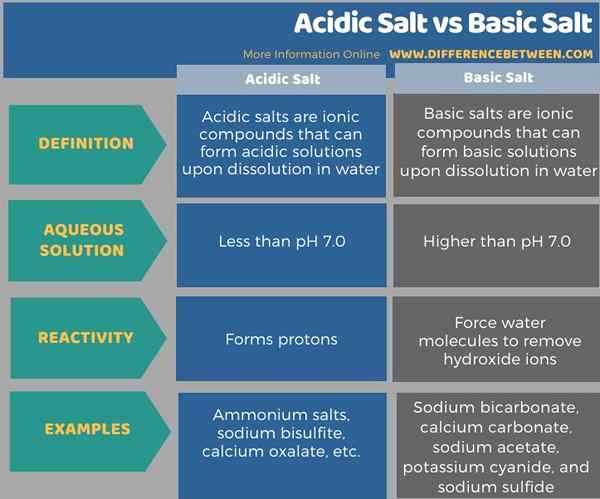
Résumé - sel acide vs sel de base
Selon la composition ionique d'un sel, les propriétés et la réactivité peuvent être déterminées. Par conséquent, nous pouvons classer un sel en trois groupes comme des sels acides, des sels de base et des sels neutres. La principale différence entre le sel acide et le sel de base est que les sels acides forment une solution inférieure à pH 7.0 Lorsqu'il est dissous dans l'eau, tandis que les sels de base forment une solution supérieure à PH 7.0 Lorsqu'il est dissous dans l'eau.
Référence:
1. «Propriétés acides des sels.Lumen de «chimie sans limites», disponible ici.
2. "7.8: Propriétés acides des sels.”Chemistry LibreTexts, LibreTexts, 3 juin 2019, disponible ici.
3. «Sel acide.»Wikipedia, Wikimedia Foundation, 17 octobre. 2019, disponible ici.
Image gracieuseté:
1. «Bisulfate de sodium» par Edgar181 - propre travail, domaine public) via les communes Wikimedia
2. «Cristaux de non-ahydrate de sulfure de sodium» par Leiem - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


