Différence entre 1 et 2s orbitaux

Différence clé - 1s vs 2s orbital
L'atome est la plus petite unité de matière. En d'autres termes, toute la matière est faite d'atomes. Un atome est composé de particules subatomiques, principalement des protons, des électrons et des neutrons. Les protons et les électrons font le noyau, qui est situé au centre de l'atome. Mais les électrons sont positionnés en orbitales (ou niveaux d'énergie) qui sont situés à l'extérieur du noyau d'un atome. Il est également important de noter que les orbitales sont des concepts hypothétiques qui sont utilisés pour expliquer l'emplacement le plus probable d'un atome. Il existe différentes orbitales entourant le noyau. Il existe également des sous-orbitales telles que S, P, D, F, etc. Le sous-orbital S est de forme sphérique lorsqu'il est considéré comme une structure 3D. L'orbitale S a la plus grande probabilité de trouver un électron autour du noyau. Un sous-orbital est à nouveau numéroté comme 1s, 2s, 3s, etc. Selon les niveaux d'énergie. La principale différence entre l'orbital 1 et 2s est l'énergie de chaque orbitale. 1s orbital a une énergie plus faible que l'orbitale 2S.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que 1S Orbital
3. Qu'est-ce que 2S Orbital
4. Comparaison côte à côte - 1s vs 2s orbitaux
5. Résumé
Qu'est-ce que 1S Orbital?
1s orbital est l'orbital le plus proche du noyau. Il a la plus faible énergie parmi les autres orbitales. C'est aussi la plus petite forme sphérique. Par conséquent, le rayon de l'orbital s est petit. Il ne peut y avoir que 2 électrons dans l'orbital S. La configuration électronique peut être écrite comme 11, S'il n'y a qu'un seul électron dans l'orbitale S. Mais s'il y a une paire d'électrons, il peut être écrit comme 12. Ensuite, les deux électrons de l'orbitale S se déplacent vers les directions opposées en raison de la répulsion qui se produit en raison des mêmes charges électriques des deux électrons. Lorsqu'il y a un électron non apparié, il est appelé paramagnétique. C'est parce qu'il peut être attiré par un aimant. Mais si l'orbital est rempli et qu'une paire d'électrons est présente, les électrons ne peuvent pas être attirés par un aimant; C'est connu comme diamagnétique.
Qu'est-ce que 2S Orbital?
L'orbitale 2s est supérieure à l'orbital 1S. Par conséquent, son rayon est plus grand que celui de l'orbital 1. C'est le prochain placard orbital du noyau après 1s orbital. Son énergie est supérieure à l'orbitale 1s mais est inférieure à celle des autres orbitales dans un atome. L'orbital 2s ne peut également être rempli qu'à un ou deux électrons. Mais l'orbital 2s n'est rempli d'électrons qu'après l'achèvement de 1S orbital. C'est ce qu'on appelle le principe Aufbau, qui indique l'ordre de remplissage d'électrons en sous-orbitales.
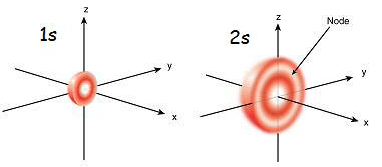
Figure 01: 1s et 2s orbitaux
Quelle est la différence entre 1 et 2s orbitaux?
1s vs 2s orbitaux | |
| 1s orbital est l'orbitale la plus proche du noyau. | L'orbitale 2S est la deuxième orbitale la plus proche du noyau. |
| Niveau d'énergie | |
| L'énergie de 1S orbitale est inférieure à celle de 2S orbitale. | 2S a une énergie relativement plus élevée. |
| Rayon d'orbital | |
| Le rayon de 1s orbital est plus petit. | Le rayon de l'orbital 2s est relativement grand. |
| Taille de l'orbite | |
| 1s orbital a la plus petite forme sphérique. | L'orbital 2s est plus grand que l'orbital 1S. |
| Remplissage d'électrons | |
| Les électrons sont d'abord remplis de l'orbital 1. | L'orbital 2s n'est rempli qu'après la fin des électrons dans l'orbital 1S. |
Résumé - 1s vs 2s orbital
Un atome est une structure 3D contenant un noyau au centre entouré d'orbitales de forme variée de différents niveaux d'énergie. Ces orbitales sont à nouveau divisées en sous-orbitales en fonction de légères différences d'énergie. Les électrons, qui est une particule subatomique majeure d'un atome, se trouve dans ces niveaux d'énergie. Les sous-orbitales 1 et 2s sont les plus proches du noyau. La principale différence entre les orbitales 1 et 2s est la différence de leur niveau d'énergie, qui est, 2S Orbital est un niveau d'énergie plus élevé que 1S orbital.
Référence:
1. LibreTexts. «Orbitales atomiques.”Chemistry LibreTexts. LibreTexts, 03 novembre. 2015. la toile. 26 mai 2017. .
2. Atomes, électrons et orbitales. N.p., n.d. la toile. 26 mai 2017. .
Image gracieuseté:
1. «S Orbitals» (Cropped) par CK-12 Foundation - File: High School Chemistry.PDF, page 265 (CC BY-SA 3.0) via Commons Wikimedia


