Différence entre 1-Butyne et 2-Butyne
Différence clé - 1-Butyne vs 2-Butyne
Tous les hydrocarbures aliphatiques simples sont largement classés en trois types en fonction de la présence de liaisons simples ou multiples en carbone: alcanes, alcènes et alcynes. Les alcanes sont des hydrocarbures saturés et ne contiennent que des liaisons à carbone unique. La formule générale de l'alcane est CnH2n + 2. Certains alcanes communs comprennent le méthane, l'éthane, le propane et le butane. Les alcènes sont les hydrocarbures insaturés non saturés avec au moins une double liaison carbone-carbone. La formule générale de l'alcène est CnH2n. L'alcène le plus simple est l'éthylène. Butene, l'hexène, le propène sont quelques exemples courants pour les alcènes. Les alcynes sont les hydrocarbures insaturés avec au moins une triple liaison carbone-carbone. La formule générale d'Alkyne est CnH2n-2. 1-butyne et 2-butyne sont deux alcynes simples qui contiennent une triple liaison en carbone-carbone à différents endroits. Les deux ont la même formule moléculaire de C4H6, mais ont quelques différences. La principale différence entre 1-Butyne et 2-Butyne est que En 1-butyène, la triple liaison se trouve entre le premier et le deuxième carbone, alors qu'en 2-butyène, il se trouve entre les deuxième et troisième atomes de carbone. En raison de cette différence, ces deux substances ont des caractéristiques entièrement différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que 1-Butyne
3. Qu'est-ce que 2-Butyne
4. Comparaison côte à côte - 1-butyne vs 2-butyne sous forme tabulaire
5. Résumé
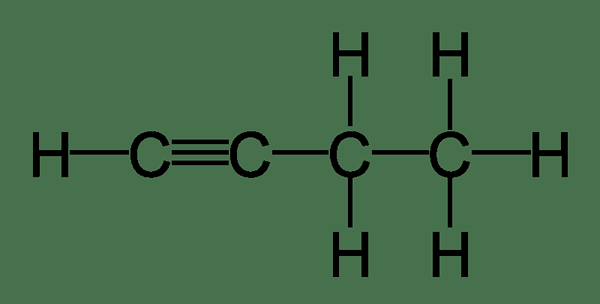
Qu'est-ce que 1-Butyne?
1-butyne est appelé un alcyne terminal en raison de la présence d'une triple liaison terminale entre les premier et deuxième atomes de carbone de la chaîne de carbone. En raison de la présence de cette liaison terminale, 1-Butyne peut être distingué du 2-butyène par deux tests principaux. Dans le premier test, la solution de chlorure de cuprous ammoniacal donne un précipité rouge avec un-butyène, entraînant un 1-butyniège en cuivre. Dans le deuxième test, la solution de nitrate d'argent ammoniacal réagit avec 1-butyne, résultant en argent 1-butynide, qui est un précipité blanc. Ces deux solutions ne réagissent pas avec 2-butyne.

Figure 01: 1-Butyne
1-Butyne est un gaz incolore extrêmement inflammable. C'est dense que l'air normal. Le nom IUPAC de 1-Butyne est But-1-Yne.
Qu'est-ce que 2-Butyne?
2-Butyne est un alcyne non terminal, qui a sa triple liaison au milieu de la chaîne de carbone, reliant les deuxième et troisième atomes de carbone. Contrairement aux alcynes terminaux, 2-Butyne ne réagit pas avec une solution de chlorure de cuprous ammoniacal ou une solution de nitrate d'argent ammoniacal pour donner des précipités caractéristiques. Les groupes alkyles terminaux de 2-butyne fournissent des électrons au carbone hybridé SP, stabilisant ainsi l'alkyène tout en diminuant la chaleur de l'hydrogénation. Par conséquent, la chaleur de l'hydrogénation est moindre en 2-butyne que dans 1-Butyne. 2-Butyne est un liquide incolore et émet une odeur de pétrole. Il a une faible densité que l'eau et n'est pas soluble dans l'eau. Le nom IUPAC est mais-2-YNE.

Figure 02: 2-Butyne
Quelle est la différence entre 1-Butyne et 2-Butyne?
1-Butyne vs 2-Butyne | |
| 1-Butyne est un alcyne terminal avec une triple liaison qui relie les premiers et deuxième atomes de carbone. | 2-Butyne est un alcyne non terminal avec une triple liaison qui relie les atomes de carbone deuxième et troisième. |
| Chaleur d'hydrogénation | |
| La chaleur de l'hydrogénation est de 292 kJ / mol. | Chaleur d'hydrogénationest 275 kJ / mol. |
| Phase | |
| 1-Butyne est un gaz incolore. | 2-butyne est un liquide incolore. |
| La stabilité | |
| 1-Butyne est moins stable que 2-Butyne en raison de la présence d'une triple liaison terminale. | 2-Butyne est plus stable. |
| Avec une solution de chlorure de cuprous ammoniacal | |
| 1-butyne donne un précipité rouge de cuivre 1-butynide. | 2-Butyne ne donne pas un tel précipité. |
| Avec une solution de nitrate d'argent ammoniacal (réactif de Tollen) | |
| 1-butyne donne un précipité blanc en acétylide d'argent. | 2-Butyne ne donne pas un tel précipité. |
| Nom IUPAC | |
| Le nom IUPAC est But-1-Yne. | Le nom IUPAC est mais-2-YNE. |
| Nom commun | |
| Le nom commun est l'éthylacétylène. | Le nom commun est le diméthylacétylène. |
Résumé - 1-Butyne vs 2-Butyne
1-Butyne et 2-Butyne sont des hydrocarbures qui appartiennent au groupe d'Alkynes. 1-Butyne est un alcyne terminal qui a une triple liaison reliant C1 et C2. C'est un gaz incolore. 2-Butyne est un liquide incolore qui a sa triple liaison reliant les atomes C2 et C3. Par conséquent, 2-butyne est un alcyne non terminal. En raison de cette différence entre 1-Butyne et 2-Butyne, ces deux hydrocarbures ont des propriétés chimiques et physiques entièrement différentes. Cependant, leur formule chimique est la même, je.e., C4H6.
Télécharger la version PDF de 1-Butyne vs 2-Butyne
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici différence entre 1-Butyne et 2-Butyne
Les références:
1. Carey, Francis A., et Richard J. Sundberg. Chimie organique avancée Partie A: Structure et mécanismes. Boston, MA, Springer US, 2007.
2. Lon, Clive. X-Kit Fet Grade 12 Phys Science Chemistry. Afrique du Sud, Pearson, 2008.
3. «1-Butyne.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici. Consulté le 8 septembre. 2017.
4. «2-Butyne.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici. Consulté le 8 septembre. 2017.
Image gracieuseté:
1. «Ethylacétylène» par Magmar452 - Propre travaux (CC0) via Commons Wikimedia
2. «Diméthylacétylène» par Edgar181 - Propre travaux (domaine public) via Commons Wikimedia


