Quelle est la différence entre l'ortho pyro et l'acide méta-phosphorique
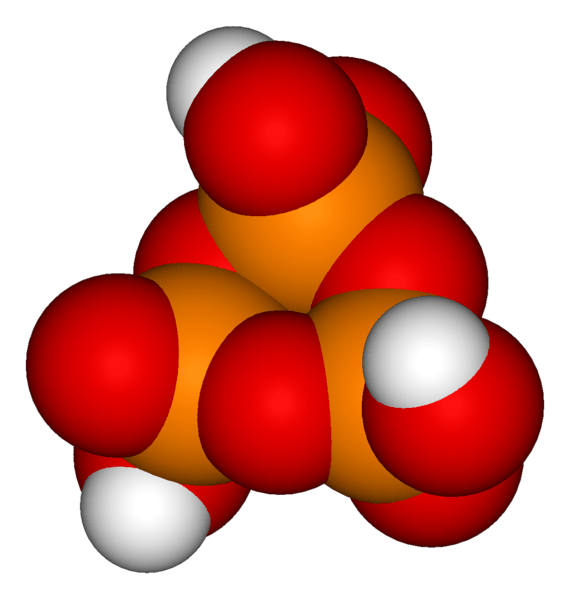
Le différence clé entre l'ortho pyro et l'acide méta-phosphorique est que l'acide ortho phosphorique contient une unité d'acide phosphorique et que l'acide pyro phosphorique contient deux unités d'acide phosphorique, tandis que l'acide phosphorique contient plus de deux unités d'acide phosphorique.
Il existe différentes formes de composés d'acide phosphorique que nous pouvons distinguer les uns des autres en fonction du nombre d'unités d'acide phosphorique qu'ils contiennent.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide ortho phosphorique
3. Qu'est-ce que l'acide pyro phosphorique
4. Qu'est-ce que l'acide méta-phosphorique
5. Ortho vs pyro vs méta-acide phosphorique sous forme tabulaire
6. Résumé - Ortho vs pyro vs méta-acide phosphorique
Qu'est-ce que l'acide ortho phosphorique?
L'acide orthophosphorique peut être défini comme un acide minéral faible ayant la formule chimique H3PO4. C'est un acide non toxique. En outre, il s'agit d'un important composé contenant du phosphore à partir duquel est dérivé l'ion phosphate de dihydrogène (H2PO4-). Par conséquent, c'est un ion très important pour les plantes car c'est la principale source de phosphore.
Lorsque l'on considère les propriétés chimiques de cette substance, sa masse molaire est de 97.99 g / mol, et le point de fusion de l'acide orthophosphorique anhydre est de 35 degrés Celsius. Il apparaît comme un solide blanc qui est délicadécent à température ambiante. Ce composé est inodore.
La production d'acide orthophosphorique a deux voies en tant que processus humide et processus thermique. Le processus humide utilise de la fluorapatite (phosphate roche) pour la production de cet acide, ainsi que de l'acide sulfurique concentré. Dans le processus thermique, le phosphore liquide (P4) et l'air subissent une réaction chimique à l'intérieur d'un four à 1800-3000 K. Tout d'abord, une machine pulvérise le liquide de phosphore dans la chambre de la fournaise. Là, le phosphore brûle dans l'air réagissant avec l'oxygène (o2). Le produit de cette étape réagit avec l'eau dans une tour d'hydratation pour produire l'acide.
L'application principale de cet acide est la production d'engrais contenant du phosphore. Il existe trois formes de sels de phosphate qui sont utilisés comme engrais: le triple phosphate, l'hydrogénphosphate de diammonium et le dihydrogénphosphate de monoammonium.
Qu'est-ce que l'acide pyro phosphorique?
L'acide pyro phosphorique est un composé inorganique ayant la formule chimique H4P2O7. Il est également connu sous le nom d'acide diphosphorique car il est formé à partir de la combinaison de deux unités d'acide phosphorique. Ce composé est incolore et inodore. De plus, il est soluble dans l'eau et dans certains solvants organiques tels que l'éther diéthylique et l'alcool éthylique.
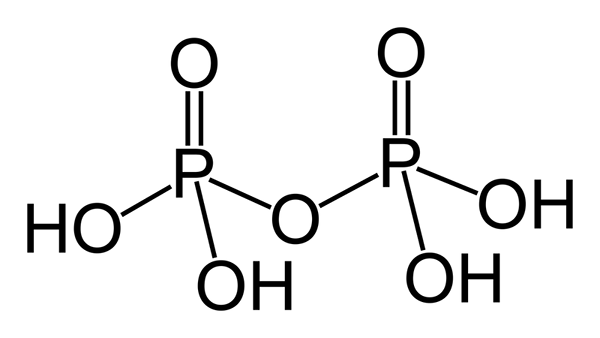
Figure 01: La structure chimique de l'acide pyro phosphorique
La forme anhydre d'acide pyrophosphorique peut crialiser sous deux formes polymorphes. L'ester, les anions et les sels de cette substance sont collectivement nommés pyrophosphates. De plus, la base conjuguée de ce composé est le pyrophosphate. Ce composé est considéré comme un composé corrosif.
Nous pouvons préparer le pyrophosphate par une technique d'échange d'ions à l'aide de pyrophosphate de sodium. Nous pouvons également le préparer à partir d'une autre méthode qui comprend le traitement du pyrophosphate de plomb avec du sulfure d'hydrogène. Habituellement, il n'est pas produit par la déshydratation de l'acide phosphorique.
Qu'est-ce que l'acide méta-phosphorique?
L'acide méta-phosphorique est un composé inorganique ayant la formule chimique HPO3. Il est également connu sous le nom hydrogène-phosphate. Il se produit comme un composé solide à température ambiante. Habituellement, ce composé se produit comme une structure cyclique où les unités d'acide phosphorique sont liées les unes aux autres dans une structure annulaire. Ici, le composé d'acide métaphosphorique le plus simple est l'acide trimétaphosphorique, qui contient trois unités d'acide phosphorique sont liées dans une structure d'anneau. Il a la formule chimique H3P3O9.

Figure 02: Structure d'acide trimétaphosphorique
Les bases conjuguées de ces composés d'acide métaphosphorique sont les métaphosphates. Un exemple courant d'un tel composé est l'hexamétaphosphate de sodium. Il est utile comme séquestrant et comme additif alimentaire.
Quelle est la différence entre l'ortho pyro et l'acide méta-phosphorique?
L'acide orthophosphorique peut être défini comme un acide minéral faible ayant la formule chimique H3PO4. L'acide pyro phosphorique est un composé inorganique ayant la formule chimique H4P2O7. L'acide méta-phosphorique est un composé inorganique ayant la formule chimique HPO3. La principale différence entre l'ortho pyro et l'acide méta-phosphorique est que l'acide orthophosphorique contient une unité d'acide phosphorique, et l'acide pyrophosphorique contient deux unités d'acide phosphorique, tandis que l'acide phosphorique contient plus de deux unités d'acide phosphorique.
L'infographie suivante énumère plus de différences entre l'ortho pyro et l'acide méta-phosphorique sous forme tabulaire pour une comparaison côte à côte.
Résumé - Ortho vs pyro vs méta-acide phosphorique
Il existe différentes formes de composés d'acide phosphorique. Nous pouvons les distinguer les uns des autres en fonction du nombre d'unités d'acide phosphorique qu'ils contiennent. La principale différence entre l'ortho pyro et l'acide méta-phosphorique est que l'acide ortho phosphorique contient une unité d'acide phosphorique, et l'acide pyro phosphorique contient deux unités d'acide phosphorique, tandis que l'acide phosphorique contient plus de deux unités d'acide phosphorique.
Référence:
1.«Acide métaphosphorique." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Pyrophosphoric-acid-2d» (domaine public) via Commons Wikimedia
2. «Trimétaphosphorique-acide-3D-VDW» (Domaine public) via Commons Wikimedia


