Quelle est la différence entre la première loi et la deuxième loi de la thermodynamique
Le Différence clé entre la première loi et la deuxième loi de la thermodynamique Est-ce que la première loi de la thermodynamique indique que l'énergie ne peut pas être créée ou détruite, et que la quantité totale d'énergie dans l'univers reste la même, tandis que la deuxième loi de la thermodynamique décrit la nature de l'énergie.
La thermodynamique fait référence à la branche des sciences physiques qui traite des relations entre la chaleur et d'autres formes d'énergie telles que l'énergie mécanique, électrique ou chimique.
CONTENU
1. Aperçu et différence clé
2. Quelle est la première loi de la thermodynamique
3. Quelle est la deuxième loi de la thermodynamique
4. Première loi vs deuxième loi de la thermodynamique sous forme tabulaire
5. Résumé - Première loi vs deuxième loi de la thermodynamique
Quelle est la première loi de la thermodynamique?
La première loi de la thermodynamique décrit que l'énergie interne d'un système est la différence entre l'énergie qu'elle absorbe de l'environnement et le travail effectué par le système sur l'environnement. Ceci est une version de la loi de conservation de l'énergie qui est adaptée aux processus thermodynamiques. Il distingue trois types de transfert d'énergie: chaleur, travail thermodynamique et énergie interne.
Nous pouvons donner la première loi de la thermodynamique sans transfert de masse comme suit:
Δu = q - w
Dans cette expression, ΔU fait référence au changement de l'énergie interne d'un système fermé, tandis que Q désigne la quantité d'énergie fournie au système comme chaleur, tandis que W est la quantité de travail thermodynamique effectué par le système sur l'environnement.

De plus, la première loi de la thermodynamique avec les besoins de transfert de masse implique d'autres conditions; Avec le compte raisonnable des états de référence correspondants du système, lorsque deux systèmes ne sont séparés que par une paroi imperméable, ils sont combinés en un nouveau système par un fonctionnement thermodynamique de l'élimination de cette paroi, ce qui conduit à l'expression suivante:
U0 = U1 + U2
Où U0 est l'énergie interne du système combiné, U1 et U2 sont les énergies internes des systèmes correspondants.
Quelle est la deuxième loi de la thermodynamique?
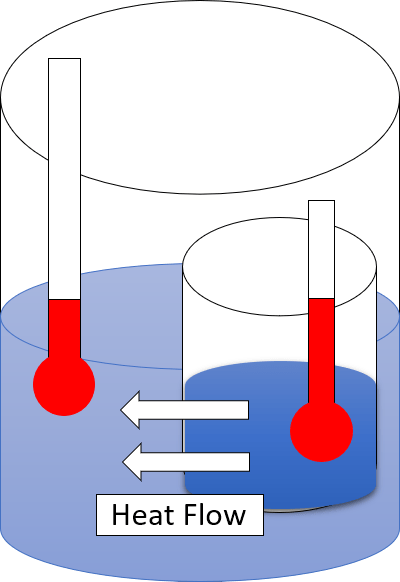
La deuxième loi de la thermodynamique décrit que la chaleur ne peut pas passer d'un emplacement plus froid à une zone plus chaude spontanément. C'est la loi physique de la thermodynamique qui décrit la chaleur et la perte dans la conversion. La façon la plus simple d'exprimer la deuxième loi de la thermodynamique est «toute énergie thermique ne peut pas être convertie en travail."
Selon les autres versions de cette loi, le concept d'entropie est établi comme une propriété physique d'un système thermodynamique. Nous pouvons formuler la deuxième loi de la thermodynamique par l'observation «L'entropie des systèmes isolés laissée à l'évolution spontanée ne peut pas diminuer car ils arrivent toujours à un état d'équilibre thermodynamique (cela se produit lorsque l'entropie est la plus élevée à l'énergie interne donnée).
Quelle est la différence entre la première loi et la deuxième loi de la thermodynamique?
La thermodynamique fait référence à la branche des sciences physiques qui traite des relations entre la chaleur et d'autres formes d'énergie telles que l'énergie mécanique, électrique ou chimique. La principale différence entre la première loi et la deuxième loi de la thermodynamique est que la première loi de la thermodynamique indique que l'énergie ne peut pas être créée ou détruite et que la quantité totale de l'énergie dans l'univers reste la même, tandis que la deuxième loi de la thermodynamique décrit que le La chaleur ne peut pas couler d'un emplacement plus froid à une zone plus chaude spontanément.
L'infographie ci-dessous présente les différences entre la première loi et la deuxième loi de la thermodynamique sous forme tabulaire pour une comparaison côte à côte.
Résumé - Première loi vs deuxième loi de la thermodynamique
La première loi de la thermodynamique décrit que l'énergie interne d'un système est la différence entre l'énergie qu'elle absorbe de l'environnement et le travail effectué par le système sur l'environnement. La deuxième loi de la thermodynamique décrit que la chaleur ne peut pas passer d'un emplacement plus froid à une zone plus chaude spontanément. C'est donc la principale différence entre la première loi et la deuxième loi de la thermodynamique.
Référence:
1. «Deuxième loi de la thermodynamique." NASA.
Image gracieuseté:
1. «Flow Flow Hot to Cold» par Blyumj - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


