Quelle est la différence entre la conductance équivalente et la conductance molaire
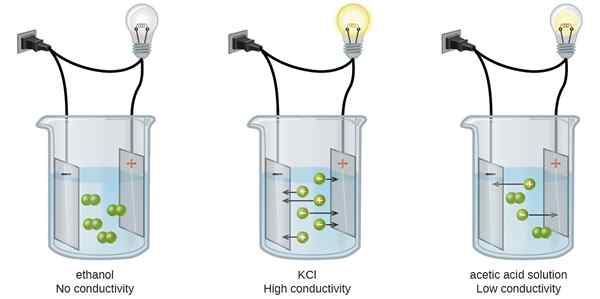
Le Différence clé entre la conductance équivalente et la conductance molaire est cette conductance équivalente est la conductance d'un électrolyte divisé par le nombre d'équivalents de l'électrolyte par volume unitaire, tandis que la conductance molaire est la conductance d'un électrolyte divisé par le nombre de moles de l'électrolyte.
La conductance molaire est la conductance de tous les ions fournis par une mole d'un électrolyte présent dans un volume défini de la solution. La conductance équivalente est la conductance d'un volume d'une solution composée d'un poids équivalent de substance dissous lorsqu'elle est placée entre deux électrodes parallèles.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la conductance équivalente
3. Qu'est-ce que la conductance molaire
4. Conductance équivalente vs conductance sous forme tabulaire
5. Résumé - Conductance équivalente vs conductance molaire
Qu'est-ce que la conductance équivalente?
La conductance équivalente est la conductance d'un volume d'une solution composée d'un poids équivalent de substance dissous lorsqu'elle est placée entre deux électrodes parallèles. Les électrodes sont placées avec une distance de 1 cm entre elles. Il est assez grand pour contenir la solution entre eux. Il peut être décrit comme la conductance nette de chaque ion qui est produit à partir d'un équivalent de gramme d'une substance particulière. Le calcul de ce paramètre est effectué comme suit:
λ = kv
Dans cette équation, λ est une conductance équivalente, k est une constante, et V est le volume en millilitres donné pour 1 gramme équivalent de l'électrolyte que nous utilisons pour cette détermination.

Qu'est-ce que la conductance molaire?
La conductance molaire est la conductance de tous les ions fournis par une mole d'un électrolyte présent dans un volume défini de la solution. Le terme conductivité molaire fait référence à la propriété d'avoir une conductance molaire.
La conductivité molaire est la conductivité d'une solution électrolytique mesurée par unité de concentration molaire de la solution. Nous pouvons le déterminer comme la conductivité de la solution électrolytique divisée par la concentration molaire de l'électrolyte. Par conséquent, nous pouvons donner la conductivité molaire dans l'équation suivante:
Conductivité molaire = k / c
k est la conductivité mesurée de la solution électrolytique, et c est la concentration de la solution électrolytique.
Lorsque l'on considère la mesure de la conductivité molaire, l'unité SI pour la mesure de cette propriété est des compteurs Siemens au carré par mole. Alors l'unité est donnée comme s m2 mol-1. Cependant, le plus souvent, l'unité de cette propriété est S CM2 mol-1.
Quelle est la différence entre la conductance équivalente et la conductance molaire?
La conductance molaire est la conductance de tous les ions fournis par une mole d'un électrolyte présent dans un volume défini de la solution. La conductance équivalente, en revanche, est la conductance d'un volume d'une solution composée d'un poids équivalent de substance dissous lorsqu'elle est placée entre deux électrodes parallèles. La principale différence entre la conductance équivalente et la conductance molaire est que la conductance équivalente est la conductance d'un électrolyte divisé par le nombre d'équivalents de l'électrolyte par volume unitaire, tandis que la conductance molaire est la conductance d'un électrolyte divisé par le nombre de moles de moles de l'électrolyte.
L'infographie ci-dessous présente les différences entre la conductance équivalente et la conductance molaire sous forme tabulaire pour une comparaison côte à côte.
Résumé - Conductance équivalente vs conductance molaire
La conductance équivalente et la conductance molaire sont deux types de conductivités. La principale différence entre la conductance équivalente et la conductance molaire est que la conductance équivalente est la conductance d'un électrolyte divisé par le nombre d'équivalents de l'électrolyte par volume unitaire, tandis que la conductance molaire est la conductance d'un électrolyte divisé par le nombre de moles de moles de l'électrolyte.
Référence:
1. «Conductivité molaire." Un aperçu | Sujets ScienceDirect.
Image gracieuseté:
1. «Conductivité (électrolytique) 2» par Karishma50 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


