Quelle est la différence entre les interactions dipolaires dipolaires et la liaison hydrogène
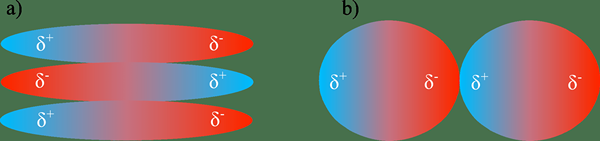
Le différence clé entre les interactions dipolaires dipolaires et la liaison hydrogène est que les interactions dipolaires dipolaires se produisent lorsque des molécules partiellement chargées interagissent avec une molécule voisine avec une charge positive, tandis que la liaison hydrogène est un type spécial de forte liaison dipolaire dipolaire qui se produit entre les atomes O, N et F et H.
Les interactions dipol-dipole et les liaisons hydrogène sont des phénomènes très importants lors de l'étude de la liaison moléculaire, des comportements moléculaires, des structures cristallines et de nombreux autres faits chimiques.
CONTENU
1. Aperçu et différence clé
2. Que sont les interactions dipolaires dipolaires
3. Qu'est-ce que la liaison hydrogène
4. Interactions dipolaires dipolaires vs liaison hydrogène sous forme tabulaire
5. Résumé - Interactions dipolaires dipolaires vs liaisons hydrogène
Que sont les interactions dipolaires dipolaires?
Les interactions dipôles-dipole ou les forces dipol-dipole sont des forces intermoléculaires qui se produisent entre les molécules polaires. Ce sont des forces électrostatiques. Lors de la formation de ce type de force, les molécules polaires ont tendance à être alignées de sorte que l'attraction entre les molécules est maximisée en réduisant l'énergie potentielle. Cet alignement réduit également les répulsions entre les molécules.

Lorsque vous envisagez une série de composés avec des masses molaires similaires (qui ont des forces d'interaction dipol-dipole entre les molécules), la résistance des forces dipol-dipole augmente à mesure que la polarité augmente. Cela se produit parce que la séparation des charges est élevée lorsque la polarité est élevée. Lorsque la molécule a une séparation de charge élevée (terminaux positifs et négatifs hautement chargés dans la même molécule), il a tendance à attirer fortement les charges opposées. Cela conduit également à une augmentation du point d'ébullition des composés. Les forces dipolaires dipolaires sont plus élevées, plus le point d'ébullition est grand.
Qu'est-ce que la liaison hydrogène?
Une liaison hydrogène peut être décrite comme un type de force d'attraction entre deux atomes de deux molécules différentes. C'est une faible force d'attraction. Cependant, par rapport à d'autres types de forces intramoléculaires, telles que les interactions polaires polaires et les interactions non polaires-nonpolaires comme les forces Vander Waal, la liaison hydrogène est beaucoup plus forte.
En règle générale, les liaisons hydrogène se forment entre les molécules covalentes polaires. Ces molécules contiennent des liaisons covalentes polaires, qui se forment à la suite de la différence dans les valeurs d'électronégativité des atomes qui sont dans la liaison covalente. Si cette différence est élevée, l'atome hautement électronégatif a tendance à attirer les électrons de la liaison vers lui-même. Ainsi, cela crée un moment dipolaire où cet atome hautement électronégatif obtient une charge négative partielle, tandis que l'autre atome obtient une charge positive partielle. Alors la liaison devient une liaison covalente polaire. Lorsque cette molécule rencontre une autre molécule qui a un moment dipolaire comme celui-ci, les charges négatives et positives ont tendance à s'attirer. Cette force d'attraction est appelée liaison hydrogène.
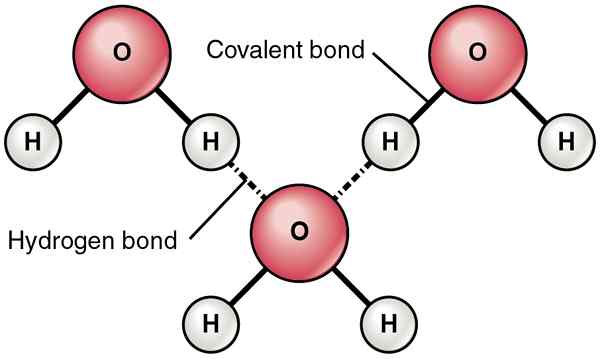
De plus, des liaisons hydrogène se forment entre des atomes hautement électronégatifs et des atomes moins électronégatifs. De plus, ils existent lorsque nous avons O, N et F dans une molécule et Host positif chargé dans l'autre molécule. En effet.
Quelle est la différence entre les interactions dipolaires dipolaires et la liaison hydrogène?
La différence clé entre les interactions dipolaires dipolaires et la liaison hydrogène est que les interactions dipolaires dipolaires se produisent lorsque des molécules partiellement chargées partiellement négativement interagissent avec une molécule voisine avec une charge positive, tandis que la liaison hydrogène est un type spécial de forte liaison dipolaire-dipôle qui se produit entre O, N , F et h atomes.
L'infographie ci-dessous présente les différences entre les interactions dipolaires dipolaires et la liaison hydrogène sous forme tabulaire pour la comparaison côte à côte.
Résumé - Interactions dipolaires dipolaires vs liaisons hydrogène
Les interactions dipol-dipole sont des forces intermoléculaires qui se produisent entre les molécules polaires, tandis que la liaison hydrogène est un type de force d'attraction entre deux atomes de deux molécules différentes. La différence clé entre les interactions dipolaires dipolaires et la liaison hydrogène est que les interactions dipolaires dipolaires se produisent lorsque des molécules partiellement chargées sont interagies avec une molécule voisine avec une charge positive, tandis que la liaison hydrogène est un type spécial de forte liaison dipolaire dipolaire qui se produit entre O, N, et les atomes F et H.
Référence:
1. «Liaison hydrogène." Chemistry LibreTexts, LibreTexts, 11 septembre. 2022.
Image gracieuseté:
1. «Interactions dipolaires» par Adam Rędzikowski - Fichier: Dipole_interactions.png (cc by-sa 3.0) via Commons Wikimedia
2. «210 liaisons hydrogène entre les molécules d'eau-01» par OpenStax College - Anatomy & Physiology, Connexions Web Site. 19 juin 2013. (CC par 3.0) via Commons Wikimedia


