Quelle est la différence entre le monohydrate d'oxalate de calcium et l'oxalate de calcium dihydrate
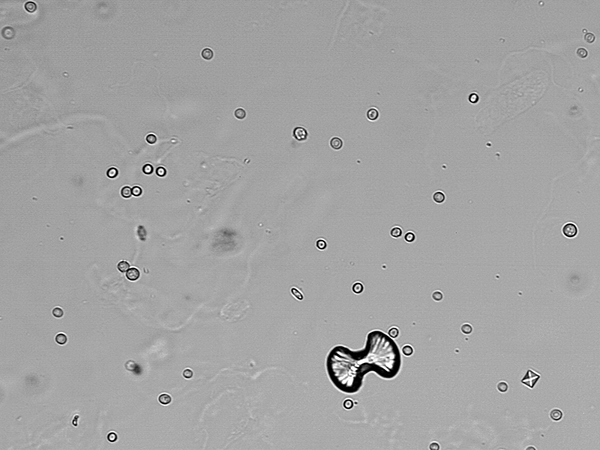
Le Différence clé entre le monohydrate d'oxalate de calcium et le dihydrate d'oxalate de calcium est que les cristaux monohydratés à oxalate de calcium ont une surface lisse, tandis que les cristaux de dihydrate d'oxalate de calcium ont des bords de déchange.
L'oxalate de calcium peut être décrit comme un sel de calcium avec l'anion oxalate. Cette substance se forme comme des hydrates ayant la formule chimique CAC2O4.NH2O. Le «N» dans cette formule peut varier de 1 à 3. S'il est nul, il peut être nommé comme l'oxalate de calcium anhydre. Cependant, les formes anhyaires et hydratées sont incolores ou blancs.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le monohydrate d'oxalate de calcium
3. Qu'est-ce que l'oxalate de calcium dihydraté
4. Monohydrate d'oxalate de calcium Vs dihydrate d'oxalate de calcium sous forme tabulaire
5. Résumé - monohydrate d'oxalate de calcium vs dihydrate d'oxalate de calcium
Qu'est-ce que le monohydrate d'oxalate de calcium?
Le monohydrate d'oxalate de calcium est un sel de calcium et d'anion oxalate ayant une molécule d'eau formant la forme d'hydrate. Par conséquent, la valeur de «n» dans le CAC2O4.La formule générale NH2O est 1. Il a une masse molaire de 146.11 g / mol. Le monohydrate d'oxalate de calcium est un composé naturel sous la forme du whewellite minéral. Cela forme des cristaux en forme d'enveloppe appelés rapides. La forme monohydratée d'oxalate de calcium est la forme la plus abondante de ce composé de sel.
Cette substance se produit à l'état solide à température ambiante et des conditions de pression. Parfois, nous pouvons le trouver comme une poudre hygroscopique blanche ou des grumeaux. Le composé parent pour le monohydrate d'oxalate de calcium est l'acide oxalique. Cette substance est utilisée comme ingrédient actif dans 7 produits majeurs, notamment Calcarea oxalica et Cal-5-Revive. De plus, il est utile dans la fabrication de glaçures en céramique, pour la séparation des métaux rare et pour l'analyse du calcium. De plus, le monohydrate d'oxalate de calcium peut provoquer une irritation, et il peut être nocif pour l'ingestion et l'absorption cutanée.

De plus, la forme des cristaux monohydrates d'oxalate de calcium peut varier. Les formes les plus courantes incluent des haltères, des broches, des ovales ou des clôtures. Les clôtures peuvent être observées en raison d'un empoisonnement à l'éthylène glycol.
Lorsque vous envisagez l'état de santé des «calculs rénaux», le type le plus courant est les pierres monohydratées oxalate de calcium. Ces pierres se forment en raison de la rétention des cristaux dans les tubules rénaux. En règle générale, ces cristaux ont tendance à adhérer aux cellules rénales et à s'agréger pour former des calculs rénaux.
Qu'est-ce que l'oxalate de calcium dihydraté?
Le dihydrate d'oxalate de calcium est un sel de calcium et d'anion oxalate ayant deux molécules d'eau, formant la forme hydratée. C'est un hydrate rare d'oxalate de calcium. Sa formule chimique peut être donnée comme CAC2O4.2h2o. Il se produit naturellement sous la forme du weddellite minéral. En règle générale, les cristaux de dihydrate d'oxalate de calcium sont octaédriques. Une grande partie des cristaux dans les sédiments d'urine affiche cette morphologie. De plus, le dihydrate d'oxalate de calcium peut croître à n'importe quel pH, et il se produit naturellement dans l'urine normale.
Manger des aliments avec un contenu riche en protéines peut provoquer la formation de pierres de déshydrate d'oxalate de calcium dans les reins. De plus, manger un régime riche en sel de sodium peut également provoquer l'accumulation de calcium dans l'urine. En règle générale, les cristaux de dihydrate d'oxalate de calcium ont des bords déchiquetés, contrairement à leur cristal monohydrate.
Quelle est la différence entre le monohydrate d'oxalate de calcium et l'oxalate de calcium dihydrate?
Le monohydrate d'oxalate de calcium est un sel d'anion calcique et oxalate ayant une molécule d'eau formant la forme d'hydrate, tandis que le dihydrate d'oxalate de calcium est un sel de calcium et un anion oxalate ayant deux molécules d'eau formant la forme hydratée. La principale différence entre l'oxalate de calcium monohydraté et le dihydrate d'oxalate de calcium est que les cristaux monohydratés à oxalate de calcium ont une surface lisse, tandis que les cristaux de dihydrate d'oxalate de calcium ont des bords de déchange.
Le tableau suivant résume la différence entre le monohydrate d'oxalate de calcium et l'oxalate de calcium dihydrate.
Résumé - monohydrate d'oxalate de calcium vs dihydrate d'oxalate de calcium
L'étude de l'oxalate de calcium est un sujet important car c'est le composant principal des calculs rénaux. Il existe deux types d'oxalate de calcium comme forme monohydrate et la forme déshydratée. La principale différence entre l'oxalate de calcium monohydraté et le dihydrate d'oxalate de calcium est que les cristaux monohydratés à oxalate de calcium ont une surface lisse, tandis que les cristaux de dihydrate d'oxalate de calcium ont des bords de déchange.
Référence:
1. Zhao, Yao-Wang, et al. «Comparaison de l'adhésion du monohydrate d'oxalate de calcium à la cellule HK-2: IJN." Journal international de nanomedicine, Presse-colombe.
2.«Monohydrate d'oxalate de calcium." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Crystals d'oxalate de calcium (urine) - Kalsiyum oksalat kristalleri (idrar) - 01” par Doruk Salancı - propre travail (CC By-Sa 3.0) via Commons Wikimedia


