Différence entre VBT et CFT
Différence clé - VBT vs CFT
Le terme VBT signifie Valence Bond Theory. C'est une théorie utilisée pour décrire la formation de différentes liaisons chimiques entre les atomes. Cette théorie explique le chevauchement ou le mélange d'orbitales atomiques pour former des liaisons chimiques. Le terme CFT signifie Crystal Field Theory. Il s'agit d'un modèle conçu pour expliquer la rupture des dégénérescences (coquilles d'électrons d'énergie égale) des orbitales électroniques (généralement d ou f orbitales) en raison du champ électrique statique produit par un anion ou des anions (ou des ligands) environnants. La principale différence entre VBT et CFT est que VBT explique le mélange d'orbitales tandis que CFT explique la division des orbitales.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que VBT
3. Qu'est-ce que CFT
4. Comparaison côte à côte - VBT vs CFT sous forme tabulaire
5. Résumé
Qu'est-ce que VBT
Le terme VBT signifie Valence Bond Theory. Il explique la liaison chimique d'un composé covalent. Par conséquent VBT explique comment une liaison covalente se forme. Une liaison covalente est formée via le partage d'électrons entre les atomes. Les atomes partagent des électrons pour remplir leur configuration d'électrons (sinon ils sont instables). Les électrons sont partagés en mélangeant ou chevauchant des orbitales atomiques. Mais avant le chevauchement, plusieurs exigences doivent être remplies.
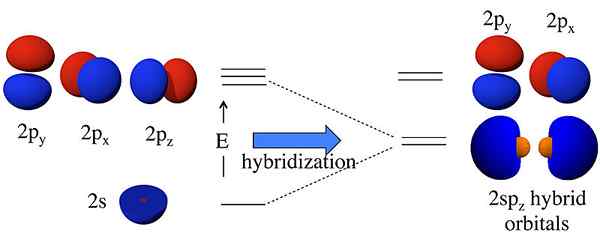
Il existe deux types d'obligations covalentes comme obligations sigma et obligations PI. Ces obligations sont formées via le chevauchement des orbitales atomiques. Le chevauchement des orbitales S forme toujours des obligations sigma. Le chevauchement des orbitales P provoque la formation d'obligations PI. Le chevauchement des orbitales atomiques S et P provoque la formation d'orbitales hybrides; Par conséquent, le processus est appelé hybridation.

Figure 01: Hybridation des orbitales 2s et 2p
Il existe trois orbitales hybrides majeures qui peuvent être formées:
- SP Hybrid Orbital - Formé via l'hybridation d'un S et d'une orbitale P.
- Sp2 Hybrid Orbital - formé par hybridation d'un S et deux orbitales P.
- Sp3 Hybrid Orbital - Formé par hybridation d'un S et trois orbitales P.
Qu'est-ce que CFT?
Le terme CFT signifie Crystal Field Theory. La théorie du champ des cristaux est un modèle conçu pour expliquer la rupture des dégénérescences (coquilles électroniques d'énergie égale) des orbitales électroniques (généralement d ou f orbitales) en raison du champ électrique statique produit par un anion ou des anions (ou des ligands) environnants. La théorie du champ cristallin est souvent utilisée pour démontrer le comportement des complexes d'ions métalliques de transition. Cette théorie peut également expliquer les propriétés magnétiques, les couleurs des complexes de coordination, les enthalpies d'hydratation, etc.
Théorie
L'interaction entre l'ion métallique et les ligands est due à l'attraction entre l'ion métallique avec une charge positive et les électrons non appariés (charge négative) du ligand. Cette théorie est principalement basée sur les changements qui se produisent dans cinq orbitales d'électrons dégénérées (un atome métallique a cinq orbitales D). Lorsqu'un ligand s'approche de l'ion métallique, les électrons non appariés sont plus proches de certaines orbitales D par rapport aux autres orbitales D de l'ion métallique. Cela provoque une perte de dégénérescence. Les électrons dans les orbitales d repoussent les électrons du ligand (les deux sont chargés négatifs). Par conséquent, les orbitales D plus proches du ligand ont une énergie élevée que les autres orbitales D. Cela entraîne le fractionnement des orbitales d en orbitales d à haute énergie et aux orbitales d basse énergie, en fonction de l'énergie.
Certains facteurs affectant ce fractionnement comprennent la nature de l'ion métallique, l'état d'oxydation de l'ion métallique, la disposition des ligands autour de l'ion métallique central et la nature des ligands. Après le fractionnement de ces orbitales D en fonction de l'énergie, la différence entre les orbitales D à faible et basse énergie est connue sous le nom de paramètre de division à plis de cristal (∆oct pour les complexes octaédriques).
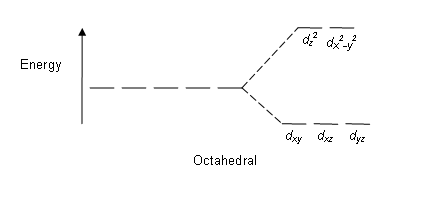
Figure 02: Modèle de division dans les complexes octaédriques
Schéma de division
Puisqu'il y a cinq orbitales d, le fractionnement se produit dans un rapport de 2: 3. Dans les complexes octaédriques, deux orbitales sont dans le niveau d'énergie élevé (collectivement connu sous le nom d'EG) et trois orbitales sont dans le niveau d'énergie inférieur (collectivement connu sous le nom de T2G). Dans les complexes tétraédriques, l'inverse se produit; Trois orbitales sont dans le niveau d'énergie plus élevé et deux dans le niveau d'énergie inférieur.
Quelle est la différence entre VBT et CFT?
VBT vs CFT | |
| Le terme VBT signifie Valence Bond Theory. | Le terme CFT signifie Crystal Field Theory. |
| Théorie | |
| VBT est une théorie qui explique la formation d'une liaison covalente via l'hybridation des orbitales atomiques. | CFT est un modèle conçu pour expliquer la rupture des dégénérescences des orbitales électroniques dues au champ électrique statique produit par un anion ou des anions environnants |
| Explication | |
| VBT explique le mélange des orbitales. | CFT explique le fractionnement des orbitales. |
Résumé - VBT vs CFT
Le terme VBT signifie Valence Bond Theory. Le terme CFT signifie Crystal Field Theory. La principale différence entre VBT et CFT est que VBT explique le mélange des orbitales tandis que CFT explique le fractionnement des orbitales.
Référence:
1. «Théorie du champ cristallin.»Wikipedia, Wikimedia Foundation, 18 février. 2018, disponible ici.
2. «Théorie des liaisons de valence.”Chemistry LibreTexts, LibreTexts, 24 janvier. 2018, disponible ici.
Image gracieuseté:
1. «Hybridation SP» par TEM5PSU - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Splating sur le champ cristallin octaédrique» par l'utilisateur anglais de Wikipedia Yana (CC By-SA 3.0) via Commons Wikimedia


