Différence entre van der Waals et interactions hydrophobes

Le différence clé entre van der waals et les interactions hydrophobes est que Les interactions de van der Waals sont des forces d'attraction entre les molécules non polaires, tandis que les interactions hydrophobes sont des forces de répulsion entre les molécules d'eau et d'autres molécules.
Il existe quatre principaux types de liaisons chimiques: les liaisons covalentes, les liaisons ioniques, les liaisons hydrogène et les interactions van der Waal. En plus de cela, nous pouvons observer les forces d'interaction entre les molécules d'eau et autres molécules nommées interactions hydrophiles et interactions hydrophobes.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les interactions van der Waals
3. Que sont les interactions hydrophobes
4. Comparaison côte à côte - Van der Waals vs interactions hydrophobes sous forme tabulaire
5. Résumé
Quelles sont les interactions van der Waals?
Les interactions de van der Waals sont des liaisons chimiques entre les molécules non polaires. Ces interactions sont un type de liaison non covalente. Ce sont des forces d'attraction faibles entre deux atomes dans deux molécules non polaires. Une interaction Van der Waals est soit une attraction induite ou une répulsion qui est causée par des corrélations dans les polarisations fluctuantes des particules voisines.
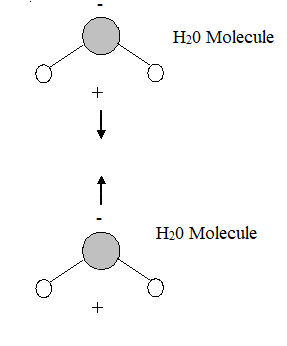
Figure 01: Interaction van der Waals
Les forces de van der Waals se produisent principalement entre les molécules symétriques telles que les molécules d'hydrogène et les molécules de dioxyde de carbone. Une interaction se forme entre deux charges opposées: les charges positives et négatives. Dans les molécules non polaires, il n'y a pas de séparation de charge, donc ces molécules ont tendance à avoir induit des charges qui font un dipôle induit. Lorsque deux molécules se rapprochent l'une de l'autre, le nuage d'électrons d'une molécule repousse le nuage électronique de l'autre molécule, appliquant une légère charge positive sur cette molécule. Ensuite, cette charge positive attire le nuage d'électrons chargé négativement de la molécule. C'est une faible force d'interaction.
Que sont les interactions hydrophobes?
Les interactions hydrophobes sont des forces de répulsion entre les molécules d'eau et d'autres substances. C'est le type d'interaction opposé à l'interaction hydrophile (force d'attraction entre les molécules d'eau et autres substances). Dans ce terme, Hydro »signifie« eau »et« phobique »signifie« peur ». Par conséquent, nous pouvons nommer des substances qui n'aiment pas l'eau comme substances hydrophobes. Ces substances repoussent les molécules d'eau. Généralement, les molécules non polaires montrent ce type d'interactions car les molécules d'eau sont polaires. En d'autres termes, les substances hydrophobes ont tendance à attirer ou à interagir avec ou se dissoudre dans des substances non polaires telles que l'huile et l'hexane.

Figure 01: La feuille est hydrophobe, donc la gouttelette se forme en une forme sphérique pour minimiser le contact avec la surface.
Parfois, les substances hydrophobes sont nommées comme substances lipophiles car ces substances attirent les composants lipidiques ou grasses. Lorsqu'une substance hydrophobe est ajoutée à l'eau, les molécules de la substance ont tendance à former des touffes en se combinant entre elles. Cela rend les solvants hydrophobes importants pour séparer les composés non polaires des solutions d'eau ou polaires.
Quelle est la différence entre Van der Waals et les interactions hydrophobes?
Les forces de van der Waals et les interactions hydrophobes sont deux types différents de liaisons chimiques. La principale différence entre van der Waals et les interactions hydrophobes est que les interactions de van der Waals sont des forces d'attraction entre les molécules non polaires, tandis que les interactions hydrophobes sont des forces de répulsion entre les molécules d'eau et d'autres molécules. Dans les interactions de van der Waals, une molécule obtient une charge positive induite tandis que d'autres molécules obtiennent une charge négative induite alors qu'il n'y a pas de séparation de charge dans les interactions hydrophobes.
Vous trouverez ci-dessous un résumé de la différence entre van der Waals et les interactions hydrophobes sous forme tabulaire.
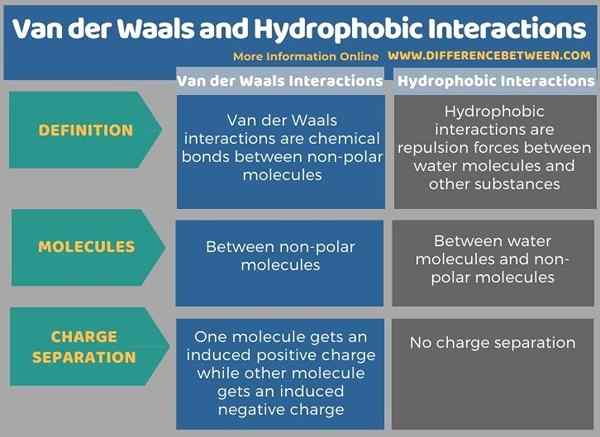
Résumé - Van der Waals vs Interactions hydrophobes
Les forces de van der Waals et les interactions hydrophobes sont deux types différents de liaisons chimiques. La principale différence entre van der Waals et les interactions hydrophobes est que les interactions de van der Waals sont des forces d'attraction entre les molécules non polaires, tandis que les interactions hydrophobes sont des forces de répulsion entre les molécules d'eau et d'autres molécules.
Référence:
1. «Van der Waals Forces.”Chemistry LibreTexts, LibreTexts, 15 août. 2020, disponible ici.
Image gracieuseté:
1. «Vanderwaals Forze Attrattive» par les utilisateurs Biopresto, Paginazero, Marc LaGrange dessus.Wikipedia Shizhao - Propre travaux (CC BY-SA 3.) via Commons Wikimedia
2. «Drop Drop on a Feu sur une photo prise par l'utilisateur Flickr Tanakawho - Flickr (CC par 2.0) via Commons Wikimedia


