Différence entre constante de gaz universel et constante de gaz caractéristique
Différence clé - constante de gaz universelle vs constante de gaz caractéristique
La phase gazeuse est l'une des trois phases principales que la matière peut exister. C'est l'état le plus compressible des trois états de la matière. Seuls 11 éléments sur d'autres éléments existent sous forme de gaz dans des conditions normales. Cependant, la «loi sur le gaz idéal» nous donne une équation qui peut être utilisée pour expliquer le comportement d'un gaz normal. Il a une constante de proportionnalité qui est appelée constante de gaz universel et lorsqu'elle est appliquée à un gaz réel, cette constante est utilisée avec une modification. Ensuite, il est appelé une constante de gaz caractéristique. La principale différence entre la constante de gaz universelle et la constante de gaz caractéristique est que La constante de gaz universelle ne s'applique qu'aux gaz idéaux alors que La constante de gaz caractéristique est applicable aux gaz réels.
CONTENU
1. Aperçu et différence clé
2. Quelle est la constante de gaz universel
3. Qu'est-ce que la constante de gaz caractéristique
4. Comparaison côte à côte - constante de gaz universelle vs constante de gaz caractéristique sous forme tabulaire
5. Résumé
Quelle est la constante de gaz universel?
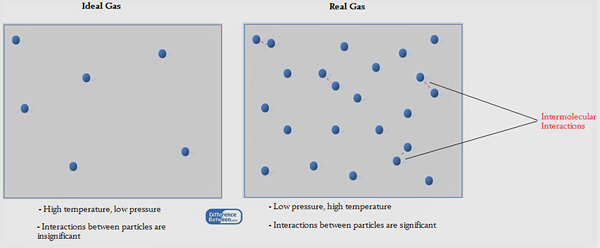
Les molécules de gaz sont capables de mouvement libre dans tout l'espace car ce sont des molécules très légères. Les forces entre les molécules de gaz sont des forces d'attraction Van der Waal faibles. Cependant, afin d'expliquer le comportement d'un gaz, les scientifiques ont dérivé des théories en utilisant un gaz hypothétique connu sous le nom de gaz idéal. Ils ont également tiré une loi concernant ce gaz idéal, qui est connu sous le nom de loi sur le gaz idéal.
Tout d'abord, nous devons savoir ce que signifie un gaz idéal. C'est un gaz hypothétique qui montrerait les propriétés suivantes si c'était un véritable gaz. Ce ne sont que des hypothèses.
- Un gaz idéal est composé d'un grand nombre de petites molécules de gaz.
- Le volume de ces molécules de gaz est négligeable.
- Il n'y a pas d'attractions entre les molécules de gaz.
- Le mouvement de ces molécules de gaz obéit à la loi de la mouvement de Newton.
- Les collisions des molécules sont complètement élastiques.
En regardant ces propriétés, il est compréhensible qu'aucun des vrais gaz ne soit idéal.
Qu'est-ce que la loi sur le gaz idéal
La loi idéale sur le gaz indique l'état d'un gaz idéal et s'explique par une équation comme suit.
PV = NRT
P - pression du gaz idéal
V - Volume du gaz idéal
N - Nombre de moles de gaz idéal (quantité de substance)
T - température
Le terme r ici est la constante de gaz universelle. La valeur de r peut être calculée en considérant la température et la pression standard qui sont 00Pression C et 1ATM. Cela donne une valeur pour la constante de gaz universelle comme 0.082057 L / (K.mol).
Qu'est-ce que la constante de gaz caractéristique?
Lors de l'application de l'équation de gaz idéale pour les gaz normaux, l'équation ci-dessus nécessite une modification car aucun des gaz réels se comporte comme un gaz idéal. Ainsi, la constante de gaz caractéristique, au lieu de constante de gaz universelle, y est utilisé. Les propriétés des gaz réels différents d'un gaz idéal peuvent être répertoriés comme ci-dessous.
- Les gaz réels sont composés de grandes molécules distinctes par rapport aux gaz idéaux.
- Ces molécules de gaz portent un certain volume.
- Il y a des forces Van der Waal faibles entre les molécules de gaz.
- Les collisions ne sont pas complètement élastiques.
Par conséquent, la loi idéale sur le gaz ne peut pas être appliquée directement à un réel gaz. Ainsi, une modification simple est effectuée; La constante de gaz universelle est divisée par la masse molaire du gaz avant de l'appliquer dans l'équation. Il peut être montré comme suit.
Rspécifique = R / m
Rspécifique - Constante de gaz caractéristique
R - constante de gaz universel
M - masse molaire du gaz
Cela peut être utilisé même pour un mélange de gaz. Ensuite, la constante R doit être divisée par la masse molaire du mélange de gaz. Cette constante de gaz caractéristique est également connue sous le nom spécifique constante Parce que sa valeur dépend du gaz ou du mélange de gaz.

Figure 01: gaz idéal vs gaz réel
Quelle est la différence entre la constante de gaz universelle et la constante de gaz caractéristique?
Constante de gaz universel vs constante de gaz caractéristique | |
| La constante de gaz universelle n'est appliquée que pour un gaz idéal. | La constante de gaz caractéristique est appliquée pour un réel gaz. |
| Calcul | |
| La constante de gaz universelle est calculée en utilisant des valeurs standard de température et de pression (STP). | La constante de gaz caractéristique est calculée avec les valeurs STP avec la masse molaire du gaz réel. |
| Relation avec le gaz | |
| La constante de gaz universelle est indépendante du gaz pris. | La constante de gaz caractéristique dépend du gaz. |
| Valeur | |
| La valeur de la constante de gaz universelle est 0.082057 L / (K.mol). | La valeur de la constante de gaz caractéristique dépendra toujours du gaz. |
Résumé - constante de gaz universel vs constante de gaz caractéristique
Un gaz idéal est un gaz hypothétique qui est supposé avoir des propriétés très différentes d'un réel gaz. La loi idéale sur le gaz est formée pour expliquer le comportement d'un gaz idéal. Cependant, en utilisant cette constante sur les gaz réels, il doit être modifié en appliquant une constante de gaz caractéristique autre que la constante de gaz universelle. C'est parce qu'aucun des gaz réels se comporte comme un gaz idéal. La principale différence entre la constante de gaz universelle et la constante de gaz caractéristique est que la constante de gaz universelle est applicable uniquement aux gaz idéaux tandis que la constante de gaz caractéristique est applicable aux gaz réels.
Télécharger la version PDF de la constante de gaz universelle vs constante de gaz caractéristique
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon les notes de citation. Veuillez télécharger la version PDF ici différence entre constante de gaz universel et constante de gaz caractéristique.


