Différence entre les réactions unimoléculaires et bimoléculaires
Différence clé - Unimoléculaire vs réactions bimoléculaires
En chimie, le terme molécularité est utilisé pour exprimer le nombre de molécules qui se réagissent pour réagir dans une réaction élémentaire. Une réaction élémentaire est une réaction en étape unique qui donne le produit final directement après la réaction entre les réactifs. Cela signifie que les réactions élémentaires sont des réactions chimiques qui n'ont pas d'étapes intermédiaires avant la formation du produit final. Les réactions unimoléculaires et bimoléculaires sont de telles réactions élémentaires. Le différence clé entre les réactions unimoléculaires et bimoléculaires est que Les réactions unimoléculaires impliquent une seule molécule comme réactif tandis que les réactions bimoléculaires impliquent deux molécules comme réactifs.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions unimoléculaires
3. Quelles sont les réactions bimoléculaires
4. Similitudes entre les réactions unimoléculaires et bimoléculaires
5. Comparaison côte à côte - réactions bimoléculaires unimoléculaires vs sous forme tabulaire
6. Résumé
Quelles sont les réactions unimoléculaires?
Les réactions unimoléculaires sont des réactions élémentaires qui impliquent une seule molécule comme réactif. Là, la réaction est une réaction de réarrangement. La molécule unique réorganise pour former des molécules plus différentes en tant que produits finaux. Mais cela se produit en une seule étape. Il n'y a pas d'étapes intermédiaires que la molécule de réactive subit dans la formation du produit final. Il donne directement les produits finaux. L'équation de la réaction peut être donnée comme
A → P
Ici, A est réactif et P est le produit. Selon le premier ordre de la loi sur le taux, la vitesse de réaction peut être donnée comme ci-dessous.
Taux = k [réactif]
Certains exemples de réactions unimoléculaires comprennent des suites:
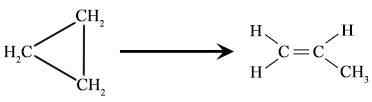
Figure 01: Réarrangement du cyclopropane pour former du propane.
- Conversion de n2O4 en deux non2 molécules
- Conversion du cyclopropane en propène
- Conversion de PCL5 en PCL3 et cl2
Quelles sont les réactions bimoléculaires?
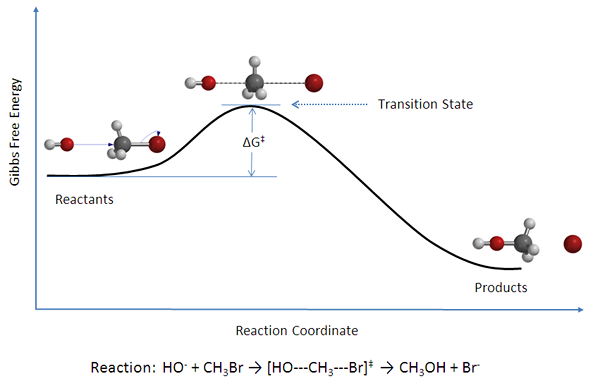
Les réactions bimoléculaires sont des réactions chimiques élémentaires qui impliquent deux molécules comme réactifs. Il peut être décrit comme la collision de deux molécules ou particules. Ce sont des réactions chimiques courantes en chimie organique et inorganique. Les deux molécules peuvent être de même ou différents types. Par exemple, les deux molécules peuvent être deux molécules NOCL avec le même arrangement atomique ou peuvent être C et O2 Avoir différentes combinaisons atomiques. Les équations des réactions bimoléculaires sont données comme ci-dessous.
A + A → P
A + B → P

Figure 02: Diagramme d'énergie pour une réaction bimoléculaire.
Puisqu'il y a deux réactifs, ces réactions sont expliquées comme des réactions de second ordre. Par conséquent, ces réactions bimoléculaires sont décrites par la loi sur la vitesse du deuxième ordre;
Taux = [a]2
Ou
Taux = [a] [b]
Dans lequel l'ordre global est toujours 2. Quelques exemples de réactions bimoléculaires sont données ci-dessous.
- Réaction entre CO et non3
- Réaction entre deux molécules NOCL
- Réaction entre Cl et CH4
Quelles sont les similitudes entre les réactions unimoléculaires et bimoléculaires?
- Les réactions unimoléculaires et bimoléculaires sont des réactions élémentaires.
- Les réactions unimoléculaires et bimoléculaires donnent le produit en une seule étape.
- Les réactions unimoléculaires et bimoléculaires n'ont pas d'étapes intermédiaires.
Quelle est la différence entre les réactions unimoléculaires et bimoléculaires?
Réactions biomoléculaires unimoléculaires vs | |
| Les réactions unimoléculaires sont des réactions élémentaires qui impliquent une seule molécule comme réactif. | Les réactions bimoléculaires sont des réactions chimiques élémentaires qui impliquent deux molécules comme réactifs. |
| Réactifs | |
| Les réactions unimoléculaires ont un réactif | Les réactions bimoléculaires ont deux réactifs. |
| Ordonnance des taux | |
| Les réactions unimoléculaires sont expliquées via le premier ordre de la loi sur les taux. | Les réactions bimoléculaires sont expliquées via la loi sur le taux de second ordre. |
| Commande globale | |
| L'ordre global de l'équation de vitesse des réactions unimoléculaires est toujours 1. | L'ordre global de l'équation de vitesse des réactions bimoléculaires est toujours 2. |
Résumé - Unimoléculaire vs réactions bimoléculaires
Les réactions unimoléculaires et bimoléculaires sont des réactions élémentaires. Ces réactions donnent le produit en une seule étape. Ces réactions peuvent également être exprimées en utilisant. La différence entre les réactions unimoléculaires et bimoléculaires est que les réactions unimoléculaires impliquent un seul réactif tandis que les réactions bimoléculaires impliquent deux molécules comme réactifs.
Téléchargez le PDF des réactions bimoléculaires unimoléculaires vs
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici: différence entre les réactions unimoléculaires et bimoléculaires
Référence:
1.«Réactions élémentaires.”Chemistry LibreTexts, LibreTexts, 26 mai 2017. Disponible ici
2.«Réaction élémentaire.»Wikipedia, Wikimedia Foundation, 10 février. 2018. Disponible ici
3.«Molecularité.»Wikipedia, Wikimedia Foundation, 13 février. 2018. Disponible ici
Image gracieuseté:
1.'Izomérisation du cyclopropane'By djokili92 - propre travail, (cc by-sa 4.0) via Commons Wikimedia
2.'RXN COORDINATINE SICHAGRAM 5'BY CHEM540GRP1F08 - PROPRE WORK, (CC BY-SA 3.0) via Commons Wikimedia


