Différence entre la trypsine et la chymotrypsine
Différence clé - trypsine vs chymotrypsine
La digestion des protéines est un processus très important dans la procédure de digestion globale dans les organismes vivants. Les protéines complexes sont digérées dans ses monomères d'acides aminés et sont absorbées via les petits intestins. Les protéines sont essentielles car elles servent un rôle fonctionnel majeur et un rôle structurel dans un organisme. La digestion des protéines se déroule via des enzymes de digestion des protéines qui incluent la trypsine, la chymotrypsine, les peptidases et les protéases. La trypsine est une enzyme de digestion des protéines qui clive la liaison peptidique aux acides aminés de base qui incluent la lysine et l'arginine. La chymotrypsine est également une enzyme de digestion des protéines qui clive la liaison peptidique à des acides aminés aromatiques tels que la phénylalanine, le tryptophane et la tyrosine. Le différence clé Entre la trypsine et la chymotrypsine est la position de l'acide aminé dans lequel il clive dans la protéine. La trypsine clive à des positions de base en acides aminés tandis que la chymotrypsine clive à des positions d'acides aminés aromatiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la trypsine
3. Qu'est-ce que la chymotrypsine
4. Similitudes entre la trypsine et la chymotrypsine
5. Comparaison côte à côte - trypsine vs chymotrypsine sous forme tabulaire
6. Résumé
Qu'est-ce que la trypsine?
La trypsine est un 23.3 kDa Protéine qui appartient à la famille des sérine protéases et ses principaux substrats sont des acides aminés de base. Ces acides aminés de base comprennent l'arginine et la lysine. La trypsine a été découverte en 1876 par Kuhne. La trypsine est une protéine globulaire et existe dans sa forme inactive qui est trypsigen - zymogen. Le mécanisme d'action de la trypsine est basé sur l'activité de la sérine protéase.
La trypsine clive à l'extrémité du terminal C des acides aminés de base. Il s'agit d'une réaction d'hydrolyse et se déroule à un pH - 8.0 dans les petits intestins. L'activation du trypsinogène a lieu par l'élimination de l'hexapeptide terminal, et il produit la forme active; trypsine. La trypsine active est de deux types principaux; α - trypsine et β-trypsine. Ils diffèrent dans leur stabilité thermique et leur structure. Le site actif de la trypsine contient de l'histidine (H63), de l'acide aspartique (D107) et de la sérine (S200).
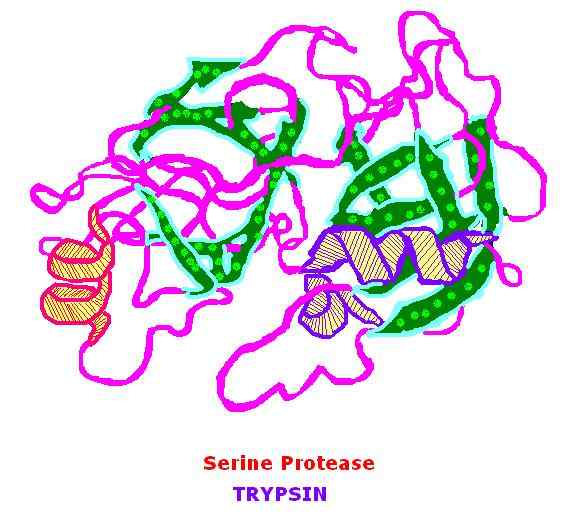
Figure 01: trypsine
L'action enzymatique de la trypsine est inhibée par DFP, aprotinine, AG+, Benzamidine et edta. Les applications de la trypsine comprennent la dissociation des tissus, la trypsization dans la culture des cellules animales, la cartographie tryptique, in vitro Études de protéines, empreintes digitales et applications de culture tissulaire.
Qu'est-ce que la chymotrypsine?
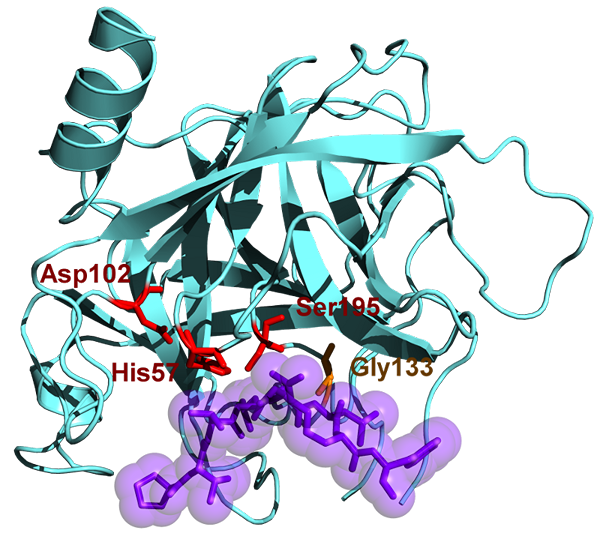
La chymotrypsine a un poids moléculaire de 25.6 kDa et appartient à la famille de la sérine protéase, et c'est une endopeptidase. La chymotrypsine existe sous sa forme inactive qui est chymotrypsiogène. La chymotrypsine a été découverte dans les années 1900. La chymotrypsine hydrolyse les liaisons peptidiques aux acides aminés aromatiques. Ces substrats aromatiques comprennent la tyrosine, la phénylalanine et le tryptophane. Les substrats de cette enzyme sont principalement dans les isomères L et agissent facilement sur les amides et les esters des acides aminés. Le pH optimal dans lequel agit la chymotrypsine est 7.8 - 8.0. Il existe deux formes principales de chymotrypsine telles que la chymotrypsine A et la chymotrypsine B et elles diffèrent légèrement dans les caractéristiques structurelles et protéolytiques. Le site actif de la chymotrypsine contient une triade catalytique et est composé d'histidine (H57), d'acide aspartique (D102) et de sérine (S195).

Figure 02: Chymotrypsine
Les activateurs de la chymotrypsine sont du bromure de cétyltriméthylammonium, du bromure de dodécyltriméthylammonium, du bromure hexadécyltriméthylammonium et du bromure de tétrabutylammonium. Les inhibiteurs de la chymotrypsine sont des aldéhydes peptidyl, des acides boroniques et des dérivés de coumarine. La chymotrypsine est utilisée commercialement dans la synthèse des peptides, la cartographie des peptides et les empreintes digitales du peptide.
Quelles sont les similitudes entre la trypsine et la chymotrypsine?
- Les deux enzymes sont des sérine protéases.
- Les deux enzymes clivent des liaisons peptidiques.
- Les deux enzymes agissent dans l'intestin grêle.
- Les deux enzymes existent dans sa forme inactive en tant que zymogènes.
- Les deux enzymes sont composées d'une triade catalytique contenant de l'histidine, de l'acide aspartique et de la sérine dans son site actif.
- Les deux enzymes ont été initialement découvertes et extraites de bovins.
- La production des deux enzymes se fait via les techniques d'ADN recombinantes actuellement.
- Les deux enzymes agissent sur un pH de base optimal.
- Les deux enzymes sont utilisées in vitro dans différentes industries.
Quelle est la différence entre la trypsine et la chymotrypsine?
Trypsine vs chymotrypsine | |
| La trypsine est une enzyme de digestion des protéines qui clivera la liaison peptidique aux acides aminés de base tels que la lysine et l'arginine. | La chymotrypsine qui est également une enzyme digérée des protéines clive la liaison peptidique à des acides aminés aromatiques tels que la phénylalanine, le tryptophane et la tyrosine. |
| Masse moléculaire | |
| Le poids moléculaire de la trypsine est de 23.3 k da. | Le poids moléculaire de la chymotrypsine est de 25.6 k da. |
| Substrats | |
| Les protéines complexes sont digérées dans ses monomères d'acides aminés et sont absorbées via les petits intestins. | Des substrats d'acides aminés aromatiques tels que la tyrosine, le tryptophane et la phénylalanine agissent sur la chymotrypsine. |
| Forme zyrogène de l'enzyme | |
| Trypsigen est la forme inactive de trypsine. | La chymotrypsiogène est la forme inactive de la chymotrypsine. |
| Activateurs | |
| Les lanthanides sont des activateurs de la trypsine. | Le bromure de cétyltriméthylammonium, le bromure de dodécyltriméthylammonium, le bromure hexadécyltriméthylammonium et le bromure de tétrabutylammonium sont des activateurs de la chymotrypsine. |
| Inhibiteurs | |
| DFP, aprotinine, AG+, La benzamidine et l'EDTA sont des inhibiteurs de la trypsine. | Les aldéhydes peptidyl, les acides boroniques et les dérivés de coumarine sont des inhibiteurs de la chymotrypsine. |
Résumé - trypsine vs chymotrypsine
Les peptidases ou les enzymes protéolytiques clivent des protéines via l'hydrolyse de la liaison peptidique. La trypsine clive la liaison peptidique à des acides aminés de base tandis que la chymotrypsine clive la liaison peptidique à des résidus d'acides aminés aromatiques. Les deux enzymes sont des sérine peptidases et agissent dans l'intestin grêle dans un environnement de pH de base. À l'heure actuelle, de nombreuses recherches sont impliquées dans la production de trypsine et de chymotrypsine en utilisant la technologie d'ADN recombinant en utilisant différentes espèces bactériennes et fongiques car ces enzymes possèdent une valeur industrielle élevée. C'est la différence entre la trypsine et la chymotrypsine.
Téléchargez la version PDF de TryPsine vs Chymotrypsine
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici différence entre la trypsine et la chymotrypsine
Référence:
1.«Chymotrypsine.”Chymotrypsine - Manuel de l'enzyme Worthington. Disponible ici
2.«Trypsin.”TRYPSIN - Worthington Enzyme Manual. Disponible ici
Image gracieuseté:
1.'Serrine Protease' par tinastella à anglais WikiBooks (domaine public) via Commons Wikimedia
2.'Chymotrypsine 4cha'by yikrazuul - propre travail, (cc by-sa 3.0) via Commons Wikimedia


