Différence entre les isotopes stables et les radio-isotopes
Différence clé - Isotopes stables vs radio-isotopes
Les isotopes sont des formes différentes du même élément chimique ayant des masses atomiques différentes. Cela signifie que les isotopes d'un certain élément chimique ont le même nombre atomique mais différentes masses atomiques. En effet, ces isotopes ont un nombre différent de neutrons dans leurs noyaux atomiques. Certains isotopes sont stables tandis que certains sont instables. Les isotopes stables sont des formes d'origine naturelle d'éléments chimiques. Ces isotopes stables peuvent se produire naturellement sous forme atomique ou en combinaison avec d'autres atomes. Les isotopes instables subissent une décroissance radioactive jusqu'à ce qu'ils obtiennent un état stable. Ces isotopes sont appelés radio-isotopes. La principale différence entre les isotopes stables et les radio-isotopes est que Les isotopes stables ne subissent pas de décroissance radioactive tandis que les radio-isotopes subissent une désintégration radioactive.
CONTENU
1. Aperçu et différence clé
2. Que sont les isotopes stables
3. Que sont les radio-isotopes
4. Comparaison côte à côte - isotopes stables vs radio-isotopes sous forme tabulaire
5. Résumé
Que sont les isotopes stables?
Les isotopes stables sont des formes différentes du même élément chimique, ayant des noyaux stables. Ces atomes ont le même nombre atomique (nombre de protons dans les noyaux atomiques) car ils appartiennent au même élément chimique, mais les masses atomiques sont différentes les unes des autres car elles ont un nombre différent de neutrons dans les noyaux atomiques.
Les isotopes stables sont non radioactifs en raison de la stabilité des noyaux atomiques. Par conséquent, ces atomes n'émettent pas de rayonnement. Un élément chimique particulier peut avoir plus d'un isotope stable. Mais dans certains éléments chimiques, tous les isotopes sont instables; Par conséquent, ils sont radioactifs.

Figure 1: Tableau périodique coloré en fonction du nombre d'isotopes stables
La stabilité des noyaux atomiques dépend de deux facteurs de base:
- Rapport entre les protons et les neutrons
- Somme de protons et de neutrons
«Nombres magiques» est un concept chimique qui est utilisé pour déterminer la stabilité d'un certain noyau atomique. Il donne le nombre d'électrons présents dans des isotopes stables. Le nombre magique peut être soit le nombre de protons, soit même le nombre de neutrons présents dans le noyau.
Nombres magiques: 2, 8, 20, 28, 50, 82 et 126
Si le nombre atomique d'un isotope est égal à l'un des nombres ci-dessus, alors c'est un isotope stable. De plus, si un isotope a 114 protons, c'est un isotope stable. De plus, s'il y a 126 ou 184 neutrons présents, ce sont également des isotopes stables. De plus, si les rapports entre les protons et les neutrons dans un atome sont des nombres, alors ces isotopes sont très probablement des isotopes stables.
Que sont les radio-isotopes?
Les radio-isotopes sont des isotopes instables d'éléments chimiques qui subissent une décroissance radioactive. Ces isotopes subissent une décroissance radioactive car elles ont des noyaux atomiques instables. La plupart des éléments chimiques ont un ou plusieurs isotopes radioactifs tandis que certains éléments chimiques n'ont que des isotopes radioactifs (Ex: Uranium).
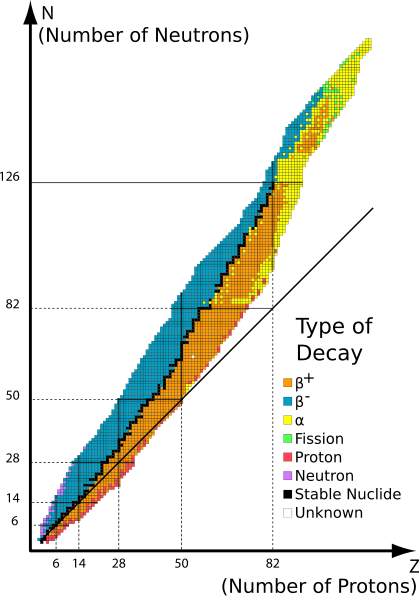
Figure 2: Différentes radio-isotopes et leur décroissance radioactive
Les isotopes radioactifs sont instables pour plusieurs raisons:
- Présence d'un nombre élevé de neutrons dans le noyau atomique par rapport au nombre de protons
- Dans ces radio-isotopes, les neutrons sont convertis en protons et électrons pendant la décroissance radioactive.
- Présence d'un nombre élevé de protons dans le noyau atomique
- Dans ces radio-isotopes, les protons sont convertis en neutrons et positrons.
- Présence d'un nombre élevé de protons et d'électrons
- Ces radio-isotopes subissent une décroissance alpha où deux protons et deux neutrons sont émis comme particules alpha
Quelle est la différence entre les isotopes stables et les radio-isotopes?
Isotopes stables vs radio-isotopes | |
| Les isotopes stables sont des formes différentes du même élément chimique, ayant des noyaux stables. | Les radio-isotopes sont des isotopes instables d'éléments chimiques qui subissent une décroissance radioactive. |
| La stabilité | |
| Les isotopes stables sont très stables et ne subissent pas de décroissance radioactive. | Les radio-isotopes sont très instables et subissent une décroissance radioactive pour obtenir un état stable. |
| Protons | |
| La présence de 114 protons fait d'un isotope un isotope stable. | La présence d'un nombre élevé de protons fait d'un isotope un radio-isotope. |
| Neutrons | |
| La présence de neutrons 126 ou 184 fait d'un isotope un isotope stable. | Le nombre de neutrons dans le rayon atomique est supérieur au nombre de protons. |
Résumé - Isotopes stables vs radio-isotopes
Les isotopes sont des atomes du même élément chimique ayant des nombres atomiques identiques mais des masses atomiques différentes. Certains isotopes sont stables alors que d'autres sont instables. Les isotopes stables sont les formes naturelles de ces éléments chimiques. Les isotopes instables sont également appelés radio-isotopes car ces isotopes subissent une décroissance radioactive pour obtenir un état stable. La principale différence entre les isotopes stables et les radio-isotopes est basé sur leur capacité à subir une décroissance radioactive.
Référence:
1. «Ratio isotopique stable.»Wikipedia, Wikimedia Foundation, 27 février. 2018, disponible ici.
2. «Que sont les radio-isotopes?”Foro Nuclear, disponible ici.
3. Britannica, les éditeurs de l'Encyclopaedia. "Nombre magique.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 12 juillet 2017, disponible ici.
Image gracieuseté:
1. «Tableau périodique par nombre d'isotopes stables» par Nergaal à l'anglais Wikipedia (CC BY-SA 3.0) via Commons Wikimedia
2. «Table Isotopes en» par table_isotopes.SVG: Napy1KenobiderIVative Work: Sjlegg (Talk) - Table_isotopes.SVG (CC BY-SA 3.0) via Commons Wikimedia


