Différence entre l'énergie de solvatation et l'énergie du réseau
Différence clé - énergie de solvatation contre Énergie réticulaire
L'énergie de solvatation est le changement de l'énergie Gibbs d'un solvant lorsqu'un soluté est dissous dans ce solvant. L'énergie du réseau est soit la quantité d'énergie libérée pendant la formation d'un réseau à partir d'ions, soit la quantité d'énergie nécessaire pour décomposer un réseau. Le différence clé entre l'énergie de solvatation et l'énergie du réseau est que L'énergie de solvatation donne le changement d'enthalpie lors de la dissolution d'un soluté dans un solvant tandis que l'énergie du réseau donne le changement d'enthalpie lors de la formation (ou de la rupture) d'un réseau.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'énergie de solvatation
3. Qu'est-ce que l'énergie du réseau
4. Comparaison côte à côte - énergie de solvatation vs énergie du réseau sous forme tabulaire
5. Résumé
Qu'est-ce que l'énergie de solvatation?
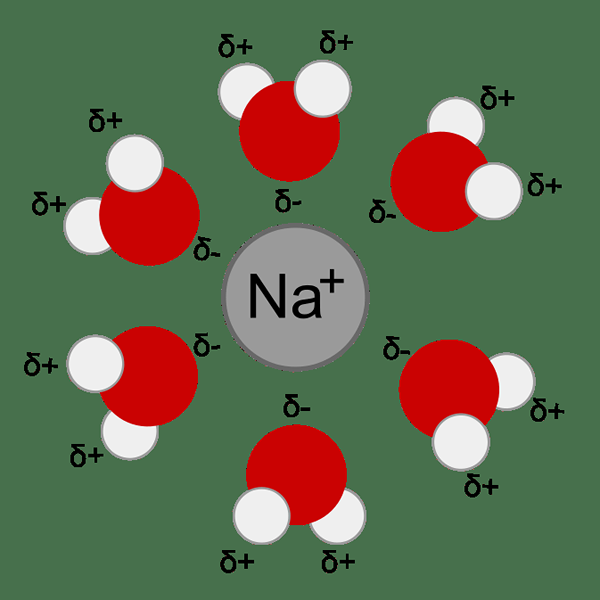
L'énergie de solvatation est le changement de l'énergie de Gibbs lorsqu'un ion ou une molécule est transféré d'un vide (ou de la phase gazeuse) en solvant. La solvatation est l'interaction entre un solvant et des molécules ou des ions d'un soluté. Le soluté est le composé qui va être dissous dans le solvant. Certains solutés sont composés de molécules alors que certains contiennent des ions.
L'interaction entre le solvant et les particules de soluté détermine de nombreuses propriétés d'un soluté. Ex: solubilité, réactivité, couleur, etc. Pendant le processus de solvatation, les particules de soluté sont entourées de molécules de solvant formant des complexes de solvatation. Lorsque le solvant impliqué dans cette solvatation est de l'eau, le processus est appelé hydratation.
Différents types de liaisons chimiques et d'interactions sont formées pendant le processus de solvatation; liaisons hydrogène, interactions ion-dipoles et forces van der Waal. Les propriétés complémentaires du solvant et du soluté déterminent la solubilité d'un soluté dans un solvant. Par exemple, la polarité est un facteur majeur qui détermine la solubilité d'un soluté dans un solvant. Les solutés polaires se dissolvent bien dans les solvants polaires. Les solutés non polaires se dissolvent bien dans les solvants non polaires. Mais la solubilité des solutés polaires dans les solvants non polaires (et vice versa) est pauvre.

Figure 01: solvatation d'un cation sodium dans l'eau
En ce qui concerne la thermodynamique, la solvatation n'est possible (spontanée) que si l'énergie Gibbs de la solution finale est inférieure aux énergies individuelles de Gibbs de solvant et de soluté. Par conséquent, l'énergie libre de Gibbs devrait être une valeur négative (l'énergie libre de Gibbs du système doit être diminuée après la formation de la solution). La solvatation comprend différentes étapes avec différentes énergies.
- Formation d'une cavité de solvant pour faire de la place pour les solutés. Ceci est thermodynamiquement défavorable car lorsque les interactions entre la molécule de solvant sont diminuées et que l'entropie est diminuée.
- La séparation de la particule de soluté du volume est également thermodynamiquement défavorable. C'est parce que les interactions soluté-solute sont diminuées.
- Les interactions solue au solvant ont lieu lorsque le soluté entre dans la cavité du solvant est thermodynamiquement favorable.
L'énergie de solvatation est également connue comme l'enthalpie de la solvatation. Il est utile d'expliquer la dissolution de certains réseaux dans les solvants alors que certains réseaux ne. Le changement d'enthalpie de la solution est la différence entre les énergies de libération d'un soluté en vrac et de combinaison de soluté avec le solvant. Si un ion a une valeur négative pour le changement de solution d'enthalpie, cela indique que l'ion est plus susceptible de se dissoudre dans ce solvant. Une valeur positive élevée indique que l'ion est moins susceptible de se dissoudre.
Qu'est-ce que l'énergie du réseau?
L'énergie du réseau est une mesure de l'énergie contenue dans le réseau cristallin d'un composé, égal à l'énergie qui serait libérée si les ions composants étaient réunis de l'infini. L'énergie du réseau d'un composé peut également être définie comme la quantité d'énergie nécessaire pour décomposer un solide ionique en ses atomes en phase gazeuse.
Les solides ioniques sont des composés très stables en raison des enthalpies de formation de molécules ioniques ainsi que de la stabilité due à l'énergie du réseau de la structure solide. Mais l'énergie du réseau ne peut pas être mesurée expérimentalement. Par conséquent, un Cycle né est utilisé pour déterminer l'énergie du réseau des solides ioniques. Il y a plusieurs termes à comprendre avant de dessiner un cycle de Born-Haber.
- Énergie d'ionisation - la quantité d'énergie nécessaire pour éliminer un électron d'un atome neutre dans le gazon
- Affinité électronique - la quantité d'énergie libérée lorsqu'un électron est ajouté à un atome neutre dans le gazeux
- Énergie de dissociation - La quantité d'énergie nécessaire pour séparer un composé en atomes ou ions.
- Énergie de sublimation - la quantité d'énergie nécessaire pour convertir un solide en vapeur
- La chaleur de formation - le changement d'énergie lorsqu'un composé est formé à partir de ses éléments.
- Loi de Hess - Une loi qui stipule que le changement global de l'énergie d'un certain processus peut être déterminé en divisant le processus en différentes étapes.
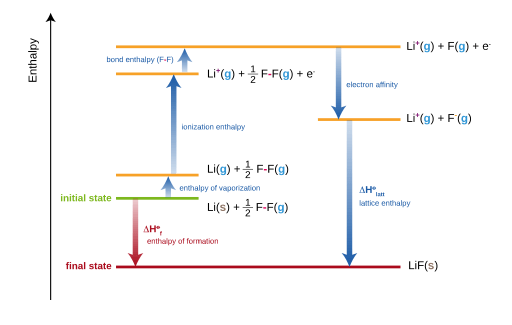
Figure 02: Le cycle Born-Haber pour la formation de fluorure de lithium (LIF)
Le cycle de Born-Haber peut être donné par l'équation suivante.
Chaleur de formation = chaleur d'atomisation + énergie de dissociation + somme des énergies d'ionisation + somme des affinités électroniques + énergie du réseau
Ensuite, l'énergie du réseau d'un composé peut être obtenue en réorganisant cette équation comme suit.
Énergie du réseau = chaleur de formation - chaleur d'atomisation + énergie de dissociation + somme des énergies d'ionisation + somme des affinités électroniques
Quelle est la différence entre l'énergie de solvatation et l'énergie du réseau?
Énergie de solvatation vs énergie du réseau | |
| L'énergie de solvatation est le changement de l'énergie de Gibbs lorsqu'un ion ou une molécule est transféré d'un vide (ou de la phase gazeuse) en solvant. | L'énergie du réseau est une mesure de l'énergie contenue dans le réseau cristallin d'un composé, égal à l'énergie qui serait libérée si les ions composants étaient réunis de l'infini. |
| Principe | |
| L'énergie de solvatation donne le changement d'enthalpie lors de la dissolution d'un soluté dans un solvant. | L'énergie du réseau donne le changement d'enthalpie lors de la formation (ou de la rupture) d'un réseau. |
Résumé - Énergie de solvatation contre Énergie réticulaire
L'énergie de solvatation est le changement d'enthalpie d'un système lors de la solvatation d'un soluté dans un solvant. L'énergie du réseau est la quantité d'énergie libérée pendant la formation d'un réseau ou la quantité d'énergie nécessaire pour décomposer un réseau. La différence entre l'énergie de solvatation et l'énergie du réseau est que l'énergie de solvatation donne le changement d'enthalpie lors de la dissolution d'un soluté dans un solvant tandis que l'énergie du réseau donne le changement d'enthalpie lors de la formation (ou de la panne) d'un réseau.
Référence:
1."Énergie réticulaire.»Chem.purger.édu. Disponible ici
2.Union internationale de chimie pure et appliquée. «Énergie de solvatation.«IUPAC Gold Book - Solvation Energy. Disponible ici
3.«Solvatation.»Wikipedia, Wikimedia Foundation, 5 mars. 2018. Disponible ici
Image gracieuseté:
1.'Na + H2O'By Taxman (domaine public) via Commons Wikimedia
2.'Born-Haber Cycle Lif'By Jkwchui - Propre travaux, (CC By-SA 3.0) via Commons Wikimedia


