Différence entre le nitrate de sodium et le nitrite de sodium

Le différence clé entre le nitrate de sodium et le nitrite de sodium est que Le nitrate de sodium apparaît sous forme de cristaux incolores tandis que le nitrite de sodium apparaît sous forme de cristaux jaunâtres.
Le nitrate de sodium et le nitrite de sodium sont des composés ioniques d'éléments chimiques de sodium, d'azote et d'oxygène. Ces deux composés diffèrent les uns des autres en fonction de l'anion présent avec le cation sodium.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le nitrate de sodium
3. Qu'est-ce que le nitrite de sodium
4. Comparaison côte à côte - nitrate de sodium vs nitrite de sodium sous forme tabulaire
5. Résumé
Qu'est-ce que le nitrate de sodium?
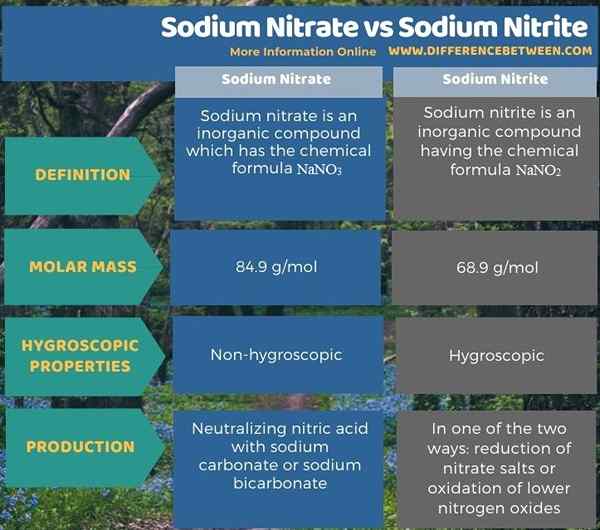
Le nitrate de sodium est un composé inorganique qui a la formule chimique nano3. Il apparaît comme un solide cristallin sans couleur blanc. Il s'agit d'un sel de nitrate de métal alcali. Ce composé est très soluble dans l'eau. Lors de la dissolution, il forme des cations de sodium et des anions de nitrate. Par conséquent, il est utile comme source disponible facilement sur les nitrates dans différents processus de synthèse, production d'engrais, etc.

Figure 01: nitrate de sodium
La masse molaire de nitrate de sodium est 84.9 g / mol. Il a une odeur douce. En plus de l'extraction des dépôts, nous pouvons également synthèser. Là, nous pouvons neutraliser l'acide nitrique avec du carbonate de sodium ou du bicarbonate de sodium. Il est également possible de faire cette neutralisation à l'aide d'hydroxyde de sodium. La structure cristalline de ce nitrate de sodium produit peut être définie comme une structure cristalline trigonale, mais parfois elle donne une structure cristalline rhomboédrique.
Qu'est-ce que le nitrite de sodium?
Le nitrite de sodium est un composé inorganique ayant la formule chimique nano2. Il a un aspect cristallin jaunâtre blanc. Ce composé est très soluble dans l'eau et hygroscopique également. La masse molaire de ce composé 68.9 g / mol. De plus, la structure cristalline du nitrite de sodium est orthorhombique. La production industrielle de nitrite de sodium peut être effectuée de deux manières: réduction des sels de nitrate ou oxydation des oxydes d'azote inférieurs.

Figure 02: nitrite de sodium
L'utilisation majeure du nitrite de sodium dans l'industrie est de produire des composés organonitrogenes. Là, nous pouvons l'utiliser comme réactif pour la conversion des amines en composés diazo. Ces composés diazo sont la clé de nombreux composés azoïques tels que les colorants. De plus, le nitrite de sodium est un médicament efficace dans l'intoxication au cyanure. C'est aussi un additif alimentaire important car l'ajout de nitrite de sodium est un moyen facile de donner à la viande transformée une couleur rose ombragée. Le goût de la viande est également amélioré par ce composé. Cependant, le nitrite de sodium a été reconnu comme un composé légèrement toxique.
Quelle est la différence entre le nitrate de sodium et le nitrite de sodium?
Le nitrate de sodium et le nitrite de sodium sont des composés ioniques d'éléments chimiques de sodium, d'azote et d'oxygène. La principale différence entre le nitrate de sodium et le nitrite de sodium est que le nitrate de sodium apparaît sous forme de cristaux incolores tandis que le nitrite de sodium apparaît sous forme de cristaux jaunâtres. L'anion en nitrate de sodium n'est pas3- Et en nitrite de sodium, ce n'est pas2-. Ces deux composés sont solubles dans l'eau mais le nitrite de sodium est également hygroscopique.
De plus, la structure cristalline du nitrate de sodium est trigonale tandis que la structure cristalline du nitrite de sodium est orthorhombique. Nous pouvons produire du nitrate de sodium en neutralisant l'acide nitrique avec du carbonate de sodium ou du bicarbonate de sodium. Nous pouvons produire du nitrite de sodium de l'une des deux manières: réduction des sels de nitrate ou oxydation des oxydes d'azote inférieurs.
Ci-dessous infographie résume la différence entre le nitrate de sodium et le nitrite de sodium.
Résumé - Nitrate de sodium vs nitrite de sodium
Le nitrate de sodium et le nitrite de sodium sont des composés ioniques d'éléments chimiques de sodium, d'azote et d'oxygène. La principale différence entre le nitrate de sodium et le nitrite de sodium est que le nitrate de sodium apparaît sous forme de cristaux incolores tandis que le nitrite de sodium apparaît sous forme de cristaux jaunâtres.
Référence:
1. Helmenstine, Anne Marie. «Comment faire pousser des cristaux de nitrate de sodium."Thoughtco, mar. 26, 2019, disponible ici.
Image gracieuseté:
1. «Dusičnan sodný» par Ondřej Manggl - propre travail (domaine public) via Commons Wikimedia
2. «Cristaux de nitrite de sodium» par w. Oelen - (CC BY-SA 3.0) via Commons Wikimedia


