Différence entre la page SDS et la page native

Différence clé - page SDS vs native Page
SDS et la page native sont deux types de techniques d'électrophorèse sur gel de polyacrylamide utilisées en biologie moléculaire. Le différence clé Entre la page SDS et la page native est le type de gel de polyacrylamide utilisé. Dans la page SDS, un gel dénaturant est utilisé, les molécules sont séparées en fonction de leur poids moléculaire. En revanche, dans la page native, des gels non dénaturés sont utilisés. Par conséquent, les molécules sont séparées en fonction de leur taille, de leur charge et de leur forme.
L'électrophorèse sur gel de polyacrylamide (PAGE) utilise un gel fabriqué par des monomères d'acrylamide polymérisants avec du méthylène bisacrylamide. Le polyacrylamide est plus dur et plus stable à la chaleur que l'agarose. Les gels de polyacrylamide ont une taille de pores plus petite qui permet une séparation efficace des protéines. Il existe deux principaux types de configurations de page à savoir la page SDS et la page native. Page SDS ou Électrophorèse en gel de polyacrylamide de sulfate de sodium sépare les protéines en fonction de leurs poids moléculaires. Les gels dénaturés sont utilisés dans la page SDS. La page native utilise des gels non dénaturés et sépare les protéines en fonction de leur taille, de leur charge et de leur forme (conformation 3D).
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la page SDS
3. Qu'est-ce que la page native
4. Similitudes entre la page SDS et la page native
5. Comparaison côte à côte - page SDS vs page native sous forme tabulaire
6. Résumé
Qu'est-ce que la page SDS?
La page SDS est la technique électrophorétique la plus courante utilisée pour séparer les protéines en fonction de leur poids moléculaire. Le gel est fabriqué en ajoutant des SD (dodécyl sulfate de sodium), qui est un détergent. SDS dentaire les protéines en monomères. SDS est un détergent anionique. Par conséquent, il ajoute une charge négative nette aux protéines dans une large plage de pH. Lorsque la charge négative nette est transmise sur les molécules de protéines, en raison de la variation de charge, les structures complexes sont décomposées. En raison de la charge négative, les protéines attirent vers la fin positive. Ainsi, les molécules avec un poids moléculaire plus faible se déplacent plus rapidement sur la matrice de gel et peuvent être observées près de l'anode, tandis que les protéines de poids moléculaire plus élevées sont observées plus près des puits.
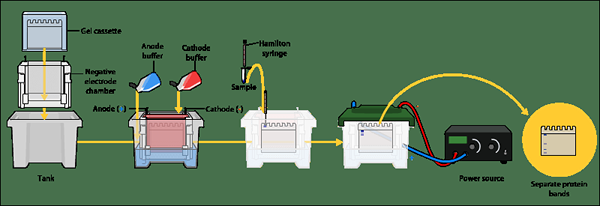
Figure 01: page SDS
La liaison SDS à la chaîne polypeptidique est proportionnelle à sa masse moléculaire relative. Par conséquent, la masse moléculaire peut également être déterminée via la page SDS. La coloration des gels de la page SDS est effectuée par coloration au bleu bromophénol. Applications de la plage de pages SDS dans une plus grande mesure où elle peut être utilisée pour estimer la masse moléculaire relative et pour déterminer l'abondance relative de protéines dans un mélange de protéines. La page SDS peut également être utilisée pour déterminer la distribution des protéines dans un mélange de protéines. La page SDS est également appliquée pour purifier et évaluer les protéines. Il est utilisé comme procédure préliminaire pour Western blot et hybridation, qui à son tour est utilisé pour la cartographie et l'identification des protéines.
Qu'est-ce que la page native?
L'électrophorèse sur gel de polyacrylamide indigène (page native) utilise un gel non dénaturant. Par conséquent, SDS ou tout autre agent de dénaturation n'est pas ajouté à la matrice de gel. Dans la page native, la séparation des protéines est basée sur la charge et la taille de la protéine. Par conséquent, la mobilité de la protéine dépend de la charge et de la taille de la protéine.
La charge de la protéine dépend des chaînes latérales des acides aminés. Si les chaînes latérales sont chargées négativement, la protéine recevra une charge négative globale et vice versa. Les protéines conservent une conformation 3D en raison du pliage qui a lieu. Résultats de pliage de plusieurs types de liaisons dans des protéines telles que les liaisons disulfure, les interactions hydrophobes et les liaisons hydrogène. Par conséquent, si la page native est transportée à un pH neutre, les protéines seront séparées en fonction de la forme moléculaire de la protéine. Par conséquent, la page native peut être utilisée comme technique sensible pour détecter le changement de charge ou de conformation de la protéine.
Le principal avantage de la page native est que la protéine utilisée pour l'analyse de page peut être récupérée dans son état d'origine après l'analyse de la page, car la protéine n'est pas perturbée pendant le processus. La page native est une technique de débit relativement élevée, et la stabilité de la protéine augmente.

Figure 02: page native
À la fin de la course de gel, le gel de page natif peut être visualisé par coloration avec du bleu bromophénol ou tout autre réactif de coloration approprié. Les applications de la page native comprennent la séparation des protéines acides, y compris les glycoprotéines telles que l'érythropoïétine recombinante humaine ou l'identification des protéines présentes dans l'albumine sérique bovine (BSA).
Quelles sont les similitudes entre la page SDS et la page native?
- La page SDS et les systèmes de pages natifs utilisent le gel de polyacrylamide comme matrice du gel.
- Les deux sont utilisés pour la séparation et l'identification des protéines.
- Les deux utilisent la mobilité électrophorétique pour séparer les composés.
- Les deux peuvent être faits de manière verticale ou horizontale (principalement réalisée en tant que configurations de pages verticales car la longueur de l'exécution est plus)).
- L'appareil d'électrophorèse comprenant le réservoir de gel, les peignes, l'alimentation est requise pour le fonctionnement des deux techniques.
- La visualisation du gel peut être effectuée par des méthodes de coloration dans les deux techniques.
Quelle est la différence entre la page SDS et la page native?
Page SDS VS Page native | |
| La page SDS ou la page de sulfate de sodium-dodecyl sépare les protéines en fonction de leur poids moléculaire, et il utilise un gel dénaturant. | La page native utilise des gels non dénaturés et sépare les protéines en fonction de leur taille, de leur charge et de leur forme (conformation 3D). |
| Type de gel | |
| Un gel dénaturant est utilisé dans SDS-PAGE. | Un gel non dénaturant est utilisé dans la page native. |
| Présence de SDS | |
| SDS est présent comme détergent pour transmettre une charge négative sur l'échantillon dans la page SDS. | SDS n'est pas présent dans la page native. |
| Base de séparation | |
| La séparation des protéines dépend du poids moléculaire de la page de la protéine dans SDS. | La séparation dépend de la taille et de la forme de la molécule protéique dans la page native. |
| Stabilité de la protéine | |
| La stabilité de la protéine est faible en page SDS. | La stabilité des protéines est élevée dans la page native. |
| Récupération de la protéine d'origine | |
| Pas possible car il est dénaturé dans la page SDS. | Possible sur la page native. |
Résumé - Page SDS vs native Page
La page SDS et la page native sont deux types de techniques d'électrophorèse sur gel de polyacrylamide utilisées pour séparer les protéines. La page SDS est traitée avec un détergent appelé SDS. SDS confère une charge négative globale à la protéine, ce qui entraîne ensuite la dénaturation de la protéine. Par conséquent, les protéines sont séparées en fonction de leur poids moléculaire. En revanche, la technique de la page native n'utilise aucun agent dénaturant. Ainsi, les protéines sont soit séparées en fonction de leur taille ou de leur forme. C'est la différence entre la page SDS et la page native.
Référence:
1.«Le principe et la méthode de l'électrophorèse sur gel de polyacrylamide (SDS-PAGE).»Le principe et la méthode de l'électrophorèse sur gel de polyacrylamide (SDS-PAGE) | Mbl Life Sience -asia-. Disponible ici
2.«Gels indigènes.«Alliance Protein Laboratories | Services de caractérisation biophysique. Disponible ici
Image gracieuseté:
1.«Electrophorèse SDS-PAGE» par BensAccount à Anglais Wikipedia, (CC par 3.0) via Commons Wikimedia
2.'Chargez un échantillon dans une électrophorèse de gel en polyacrylamide bien blaz nemec de Ljubljana, Slovénie (CC By-Sa 2.0) via Commons Wikimedia


