Différence entre les orbitales PX Py et PZ
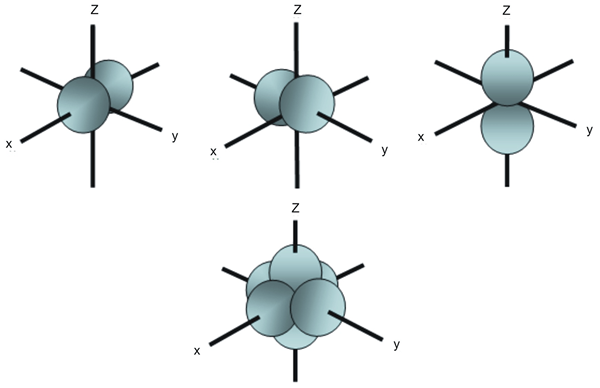
La principale différence entre les orbitales Px Py et Pz est que le L'orbital PX a deux lobes orientés le long de l'axe x et l'orbital Py a deux lobes orientés le long de l'axe y tandis que l'orbital PZ a deux lobes orientés le long de l'axe z. Par conséquent, la différence entre les orbitales PX PY et PZ provient de leur orientation dans l'espace.
Une orbitale atomique est une région autour d'un noyau atomique, qui a la plus grande probabilité de trouver un électron. Les orbitales d'un atome peuvent être orbitales, orbitales p, orbitales ou orbitales f. De plus, il y a trois orbitales p; Ce sont des orbitales PX, PY et PZ.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une orbitale PX
3. Qu'est-ce qu'une orbitale py
4. Qu'est-ce qu'une orbitale PZ
5. Similitudes entre Px Py et Pz Orbitals
6. Comparaison côte à côte - PX vs py vs orbitales pz sous forme tabulaire
7. Résumé
Qu'est-ce qu'une orbitale PX?
PX Orbital est l'une des trois orbitales P et des orients le long de l'axe X. De plus, cette orbitale a deux lobes et a une forme d'haltères. Les numéros quantiques sont un ensemble de nombres qui aident à nommer des orbitales atomiques. Ce système donne à une orbitale atomique particulière un nom unique.

Figure 1: Différentes orbitales p et leurs orientations
Nombres quantiques:
- Principe le numéro quantique (n) décrit la coque électronique. Ex: n = 1, 2, 3…
- Le nombre quantique azimutal ou le nombre quantum de moment angulaire (L) explique les sous-coquilles. Ex: l = 0, 1, 2…
- Le numéro quantique magnétique (m) indique l'état quantique unique d'un électron. Ex: m =… -2, -1, 0, +1, + 2…
- Le (s) numéro quantique (s) décrit le spin d'un électron. Ex: s = ±
Lorsque vous envisagez l'orbital PX, la notation quantique est la suivante.
- Lorsque n = 1, il n'y a pas d'orbitales p.
- Lorsque n> 2 et l = 1, il y a des orbitales p. Alors, px est soit m = +1 ou m = -1.
- Avec l'augmentation des valeurs N, la taille du lobe extérieur de l'orbitale PX augmente progressivement tandis que la taille du lobe intérieur diminue.
Qu'est-ce qu'une orbitale py?
Py Orbital est l'une des trois orbitales P orientées le long de l'axe y. Cette orbitale a deux lobes. La notation quantique de l'orbitale py est la suivante.
- Lorsque n = 1, il n'y a pas d'orbitales p.
- Lorsque n> 2 et l = 1, il y a des orbitales p. Alors, py est m = +1 ou m = -1.
- Avec l'augmentation des valeurs N, la taille du lobe extérieur de l'orbitale Py augmente progressivement tandis que la taille du lobe intérieur diminue.
Qu'est-ce qu'une orbitale PZ?
Pz orbital est l'une des trois orbitales P orientées le long de l'axe Z. Cette orbitale a deux lobes et a une forme d'haltère. La notation quantique de l'orbitale py est la suivante:
- Lorsque n = 1, il n'y a pas d'orbitales p.
- Lorsque n> 2 et l = 1, il y a des orbitales p. Alors, pz est soit m = 0.
- Avec l'augmentation des valeurs N, la taille du lobe extérieur de l'orbitale PZ augmente progressivement tandis que la taille du lobe intérieur diminue.
Quelles sont les similitudes entre les orbitales PX Py et PZ?
- Les orbitales PX PY et PZ ont une forme similaire (forme d'haltères).
- Les trois orbitales P ont une taille similaire.
- Les tailles de ces orbitales changent avec l'augmentation de la valeur n.
- Les trois orbitales contiennent deux lobes le long de la même orientation de l'axe.
Quelle est la différence entre les orbitales PX Py et PZ?
Px py vs orbitals pz | ||
| PX Orbital est un orbital p le long de l'axe X. | Py Orbital est une orbitale p le long de l'axe y. | PZ Orbital est une orbitale P le long de l'axe Z. |
| Orientation | ||
| Le long de l'axe x | Le long de l'axe y | Le long de l'axe z |
| Valeur du nombre quantique magnétique (m) | ||
| La valeur du nombre quantique magnétique (m) est de +1 ou -1. | La valeur du nombre quantique magnétique (m) est de +1 ou -1 | La valeur du nombre quantique magnétique (m) est 0 (zéro) |
Résumé - Px Py vs PZ Orbitals
Il y a trois orbitales atomiques p dans un atome. Les noms PX, PY et PZ, indiquent l'orientation de l'orbitale dans l'espace. La principale différence entre les orbitales PX PY et PZ est que Px Orbital a deux lobes orientés le long de l'axe X et Py Orbital a deux lobes orientés le long de l'axe Y alors que l'orbital PZ a deux lobes orientés le long de l'axe Z.
Référence:
1. «Orbital atomique.»Wikipedia, Wikimedia Foundation, 24 avril. 2018, disponible ici.
2. LibreTexts. «Orbitales atomiques.”Chemistry LibreTexts, LibreTexts, 7 février. 2018, disponible ici.
3. Agray, Santosh. «Formes d'orbitales.”CHIMIEST BUR, DISPONIBLE ICI.
Image gracieuseté:
1.«PX Py PZ Orbitals» par CK-12 Foundation - File: High School Chemistry.PDF, page 268 (CC BY-SA 3.0) via Commons Wikimedia


