Différence entre la valence primaire et secondaire
Le différence clé entre la valence primaire et secondaire est que La valence primaire est l'état d'oxydation de l'atome métallique central d'un complexe de coordination tandis que la valence secondaire est le nombre de coordination de l'atome métallique central d'un complexe de coordination.
Les termes primaire et secondaire sont sous la chimie de la coordination. La valence est la puissance de combinaison d'un élément, en particulier tel que mesuré par le nombre d'atomes d'hydrogène qu'il peut déplacer ou combiner avec.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la valence primaire
3. Qu'est-ce que la valence secondaire
4. Comparaison côte à côte - primaire vs valence secondaire sous forme tabulaire
5. Résumé
Qu'est-ce que la valence primaire?
La valence primaire est l'état d'oxydation de l'atome métallique central d'un complexe de coordination. Un complexe de coordination est un composé compliqué qui a un ion métallique au centre, qui est entouré de plusieurs atomes ou groupes d'atomes. Ces espèces chimiques environnantes sont appelées ligands. L'atome métallique central se lie à un certain nombre de ligands en fonction de la configuration électronique de cet atome. Le nombre de ligands qui se lie à l'atome métallique central est appelé le numéro de coordination.
En outre, l'atome métallique central a son propre état d'oxydation. Nous pouvons calculer l'état d'oxydation en utilisant la formule chimique du complexe. Ici, si nous connaissons la charge électrique nette du complexe, les charges et le nombre de ligands attachés à l'atome métallique, nous pouvons facilement calculer l'état d'oxydation. En d'autres termes, la valence primaire est le nombre de ligands dont nous avons besoin pour satisfaire la charge sur l'ion métallique.
Qu'est-ce que la valence secondaire
La valence secondaire est le numéro de coordination de l'atome métallique central d'un complexe de coordination. Le numéro de coordination est le nombre de ligands attachés à l'atome métallique central. Considérons un exemple pour comprendre les valences primaires et secondaires. Dans le complexe de coordination k4[Fe (CN)6] L'atome métallique central est le fer (Fe).

Figure 02: Le nombre de coordination de soufre dans ce composé de coordination est quatre
Nous pouvons calculer la valence primaire comme ci-dessous:
- La charge du ligand potassium est toujours +1.
- La charge du ligand du cyanure (CN) est toujours -1.
- Il y a quatre ligands de potassium qui égalent à +4 charge.
- Il y a six ligands de cyanure (CN) qui équivaut à -6 charge.
- Ensuite, nous pouvons calculer l'état d'oxydation de Fe comme suit:
La charge totale du complexe = 0
0 = [(Charge du ligand potassium) x 4] + [Charge de la Fe ion] + [(charge du ligand cyanure) x 6]
0 = [(+1) x 4] + [Charge du Fe ion] + [(-1) x 6]
0 = 4 + [Charge de la Fe ion] - 6
Charge du Fe ion = +2
État d'oxydation de Fe = +2
Quelle est la différence entre la valence primaire et secondaire?
Les termes primaire et secondaire viennent dans le domaine de la chimie de la coordination. Ici, la principale différence entre la valence primaire et secondaire est que la valence primaire est l'état d'oxydation de l'atome métallique central d'un complexe de coordination. Mais, la valence secondaire est le numéro de coordination de l'atome métallique central d'un complexe de coordination. De plus, la valence primaire est le nombre de ligands dont nous avons besoin pour satisfaire la charge sur l'ion métal.
En dessous de l'infographie résume la différence entre la valence primaire et secondaire.
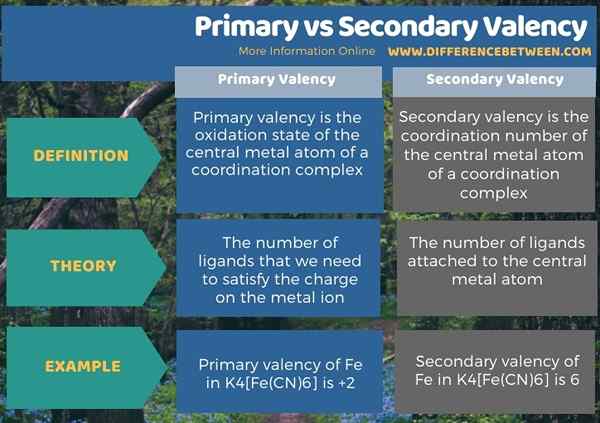
Résumé - primaire vs valence secondaire
Les termes primaire et secondaire de la valence relèvent de la chimie de la coordination. La principale différence entre la valence primaire et secondaire est que la valence primaire est l'état d'oxydation de l'atome métallique central d'un complexe de coordination. Mais, alors que la valence secondaire est le numéro de coordination de l'atome métallique central d'un complexe de coordination.
Référence:
1. «Métaux de transition.»Complexes de coordination et ligands, disponibles ici.
2. «Hybridation orbitale.»Wikipedia, Wikimedia Foundation, 14 novembre. 2019, disponible ici.
3. «Chimie sans limites.”Lumen, disponible ici.
Image gracieuseté:
1. «Di Xeno» par Officier781 - Propre travaux (domaine public) via Commons Wikimedia
2. «Tetra Sulf» par Officier781 - Propre travaux (domaine public) via Commons Wikimedia


