Différence entre PKA et PKB
Différence clé - PKA VS PKB
PKA et PKB sont des termes communs en chimie qui sont appelés constantes de dissociation. PKA est constante de dissociation acide, Et PKB est constante de dissociation de base. Ces termes sont utilisés pour faciliter le travail avec des valeurs très grandes ou très petites. Le «P» dans ces termes représente le «logarithme négatif». Le différence clé Entre PKA et PKB est que La PKA est le logarithme négatif de KA alors que PKB est le logarithme négatif de KB.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que PKA
3. Qu'est-ce que PKB
4. Relation entre PKA et PKB
5. Comparaison côte à côte - PKA VS PKB sous forme tabulaire
6. Résumé
Qu'est-ce que PKA?
PKA est le logarithme négatif de KA. Ka est la constante de dissociation acide d'une solution. C'est une mesure quantitative de la force d'un acide dans une solution. Les acides sont des composés chimiques qui peuvent libérer un ou plusieurs ions hydrogène (protons) à une solution. Si la dissociation acide constante; Ka est plus élevé, cela signifie que l'acide est complètement (ou presque complètement) dissocié en ions formant des ions hydrogène. Ensuite, cela indique que l'acide est un acide fort. Étant donné que la PKA est la valeur logarithmique négative de Ka, la PKA est une valeur plus petite pour l'acide fort.
pka = -logdixKun
Abaisser la vlaue pka, plus l'acide est fort. De même, la valeur PKA est élevée, plus l'acide est faible. En regardant les valeurs PKA de différents acides, on peut comparer les forces d'acide relatif. Au lieu d'utiliser les valeurs KA, les valeurs PKA sont utilisées en commun car il facilite le travail avec des nombres très grands ou très petits avec de petites décimales.

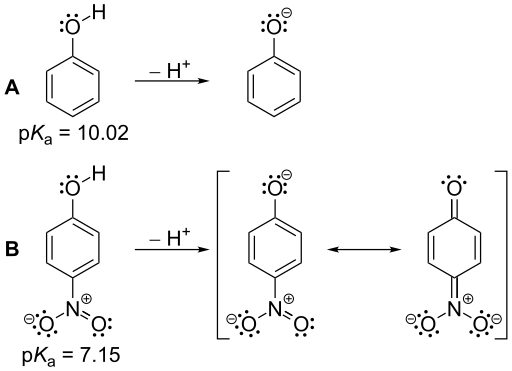
Figure 01: Les valeurs de PKA du phénol et du nitrophénol: le nitrophénol est un acide plus fort que le phénol en raison de sa valeur PKA plus petite par rapport au nitrophénol.
En plus de comparer la résistance à l'acide, les valeurs PKA sont également utilisées pour sélectionner des tampons appropriés. Selon l'équation de Henderson-Hasselbalch, il existe une relation entre le pH et la PKA d'un système.
pH = pkun + enregistrerdix([UN-] / [Ah])
Pour la dissociation de l'acide HA. Cette équation peut être réécrite comme ci-dessous.
Kun/ [H+] = [A-] / [Ah]
Selon cette équation, les valeurs PKA et pH du même système sont égales lorsque la moitié de l'acide a été dissociée. Étant donné que la capacité tampon d'un système est sa capacité à maintenir le pH d'une solution, le tampon doit être sélectionné dans lequel la PKA et le pH sont très proches les uns des autres.
Qu'est-ce que PKB?
PKB est le logarithme négatif de KB. Kb est la constante de dissociation de base. Il est utilisé pour déterminer la force d'une base quantitativement. Lorsqu'une base est dissoute dans l'eau, elle se dissocie en ions formant une solution de base. Des bases fortes se dissocient complètement. Les bases faibles se dissocient partiellement.
pkb = -logdixKb
Le «P» dans PKB signifie «Logarithme négatif». Étant donné que la plupart des valeurs KB sont très grandes ou très petites, les logarithmes négatifs de ces valeurs sont utilisés pour faciliter la gestion. Par conséquent, une grande valeur KB peut être caractérisée par une petite valeur PKB avec de petites décimales.
Quelle est la relation entre PKA et PKB?
La relation entre Ka et KB est donnée comme ci-dessous.
Kw = ka.Kb
Ensuite, la relation entre PKA et PKB est donnée comme (à 25oC)
PKA + PKB = 14
Quelle est la différence entre PKA et PKB?
PKA VS PKB | |
| PKA est le logarithme négatif de KA. | PKB est le logarithme négatif de KB. |
| Nature | |
| La PKA est donnée pour les acides. | PKB est donné pour les bases. |
| Relation avec la dissociation constante | |
| La PKA est liée à la constante de dissociation acide. | PKB est lié à la constante de dissociation de base. |
| Les indications | |
| La valeur PKA plus petite, l'acide est plus fort. | La valeur PKB plus petite, plus faible de la base. |
Résumé - PKA VS PKB
PKA et PKB sont utilisés pour comparer respectivement la résistance des acides et des bases. La PKA est donnée pour les dissociations acides. PKB est donné pour la dissociation des bases. La différence entre PKA et PKB est que la PKA est le logarithme négatif de KA alors que PKB est le logarithme négatif de KB.
Téléchargez le PDF de PKA vs PKB
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici: différence entre PKA et PKB
Référence:
1.Helmenstine, Anne Marie, D. «Définition PKA en chimie.”Thoughtco, sept. 15, 2017. Disponible ici
2.Helmenstine, Anne Marie, D. «Relation du pH et de la PKA: l'équation de Henderson-Hasselbalch.”Thoughtco, dec. 1, 2017. Disponible ici
3.«Relation entre KA et KB.”Khan Academy. Disponible ici
Image gracieuseté:
1.'PKA PHENOL VS NITROPHENOL'BY HBF878 - Propre travaux, (domaine public) via Commons Wikimedia


