Différence entre le pH et l'acidité titrable
Le différence clé entre le pH et l'acidité titrable est que le Le pH mesure la concentration de protons libres dans une solution tandis que l'acidité titrable mesure la somme des protons libres et des acides non dissociés dans une solution.
L'acidité d'une solution mesure la capacité de cette solution à neutraliser une base. En effet. Lorsque l'acide réagit avec la base, les ions H + et les ions oh- réagissent les uns avec les autres pour former des molécules d'eau (H2O). Par conséquent, c'est une réaction de neutralisation.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le pH
3. Qu'est-ce que l'acidité titrable
4. Comparaison côte à côte - PH vs acidité titrable sous forme tabulaire
5. Résumé
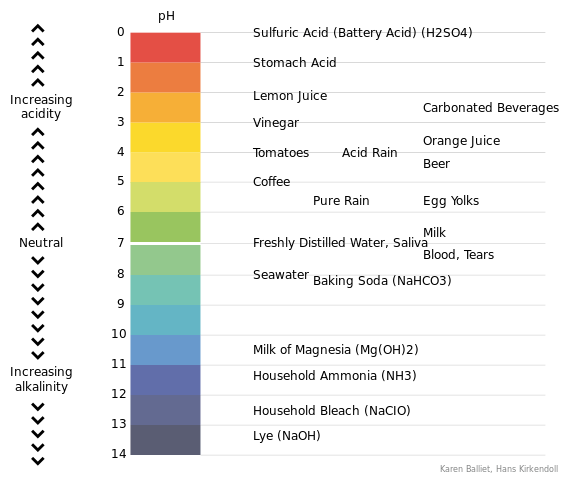
Qu'est-ce que le pH?
Le pH est une mesure de la concentration de protons libres (ions H +) dans une solution. Ces protons sont les ions H + qui se dissocient des acides. Par conséquent, en mesurant le pH d'une solution, nous pouvons mesurer la résistance à l'acide d'une solution. Cela signifie que nous pouvons mesurer la capacité de cette solution pour neutraliser une base. Si une solution est acide, la valeur du pH est inférieure à 7. Mais si la solution est alcaline, le pH de cette solution est supérieur à 7.

Figure 01: échelle de pH
Nous considérons le pH 7 comme la valeur de pH neutre. Nous pouvons mesurer le pH d'une solution à l'aide d'un pH-mètre. L'équation du calcul du pH en utilisant la concentration de protons libres est la suivante;
pH = -log [h +]
Qu'est-ce que l'acidité titrable?
L'acidité titrable (TA) est une mesure de l'acidité totale en tant que valeur approximative. Cela signifie que l'acidité titrable donne la somme des protons libres et des acides non dissociés dans une solution. Mais, c'est une approximation de l'acidité totale car elle ne peut pas mesurer toutes les espèces acides dans la solution (l'acidité totale est une mesure plus précise).
L'unité de mesure de ce paramètre est des grammes par litre (g / L). De plus, cette acidité donne la concentration totale de protons dans une solution qui peut réagir avec une base forte pour neutraliser la base. Ex: Naoh est une base forte qui est couramment utilisée dans la mesure de Ta.
Quelle est la différence entre le pH et l'acidité titrable?
Le pH est une mesure de la concentration de protons libres (ions H +) dans une solution et ce paramètre est sans unité. Tandis que l'acidité titrable (TA) est une mesure de l'acidité totale en tant que valeur approximative. L'unité de mesure pour ce paramètre est des grammes par litre (g / L). C'est la principale différence entre le pH et l'acidité titrable.

Résumé - PH vs acidité titrable
Le pH et l'acidité titrable sont des paramètres très importants pour déterminer la qualité du sol à l'aide d'une solution de sol. La différence entre le pH et l'acidité titrable est que le pH mesure la concentration de protons libres dans une solution tandis que l'acidité titrable est une mesure de la somme des protons libres et des acides non dissociés dans une solution.
Référence:
1. «Acidité titrable.”Mait le wiki Funk. Disponible ici
2. "PH.»Wikipedia, Wikimedia Foundation, 2 juillet 2018. Disponible ici
Image gracieuseté:
1.'Power of Hydrogène (PH) Chart'By Hans Kirkendoll - Propre travaux, (CC0) via Commons Wikimedia


