Différence entre le modèle de particules de la matière et la théorie moléculaire cinétique
Différence clé - Modèle de particules de la matière vs théorie moléculaire cinétique
Le modèle de matière de particules est un modèle utilisé pour expliquer la disposition des atomes, des molécules ou des ions qui sont présents dans tout matériau. La théorie moléculaire cinétique est une théorie utilisée pour expliquer les propriétés physiques d'un gaz. La principale différence entre le modèle de particules de matière et la théorie moléculaire cinétique est que Le modèle de matière des particules décrit les propriétés des phases solides, liquides et gazeuses de la matière tandis que la théorie moléculaire cinétique décrit les propriétés des gaz.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le modèle de particules de la matière
3. Qu'est-ce que la théorie moléculaire cinétique
4. Comparaison côte à côte - Modèle de particules de la matière vs théorie moléculaire cinétique sous forme tabulaire
5. Résumé
Qu'est-ce que le modèle de particules de la matière?
Le modèle de matière de particules est un modèle qui explique la disposition des particules (atomes, molécules ou ions) dans une certaine phase de matière. Il existe trois phases principales n'importe quelle matière peut exister: phase solide, phase liquide et phase gazeuse. Le modèle de particules exprime les concepts suivants:
- Toute la matière est construite à partir de petites particules.
- Ces minuscules particules sont toujours en mouvement.
- Il y a des espaces vides entre ces particules.
- Lorsque la matière est chauffée, le mouvement des particules augmente.
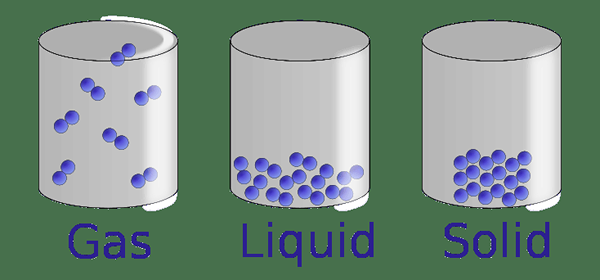
Figure 1: Les trois phases de la matière
Phase solide
La phase solide est la phase de la matière dans laquelle les particules (atomes, molécules ou ions dont le solide est fait) sont tenues étroitement. Par conséquent, les particules sont très étroitement emballées. Il y a de très minuscules espaces vides entre les particules. Il existe de très fortes interactions intermoléculaires entre les particules. Ces caractéristiques donnent aux solides une forme particulière. Étant donné que les particules sont étroitement emballées, les particules présentent un mouvement presque négligeable (des vibrations peuvent être observées la plupart du temps; donc les particules restent dans certaines positions). Comme le solide obtient une forme fixe, il a également un volume fixe. La densité d'un solide est très élevée par rapport aux liquides et aux gaz.
Phase liquide
La phase liquide est une phase de matière dans laquelle les particules sont emballées étroitement ensemble, mais ce n'est pas un emballage serré comme dans les solides. Les espaces vides entre les particules sont grands par rapport aux solides, mais sont petits par rapport aux gaz. Les particules peuvent se déplacer librement. Le liquide n'a pas de forme définie; il obtient la forme du récipient dans lequel le liquide est présent. La densité d'un liquide est inférieure à celle d'un solide et supérieur à celle d'un gaz. Cependant, un liquide a un volume fixe car les particules sont emballées étroitement.
Phase gazeuse
La phase gazeuse est une phase de matière dans laquelle les particules sont en mouvement continu dans des directions aléatoires. Par conséquent, il existe de grands espaces entre les particules de gaz. Ces particules remplissent un récipient fermé dans lequel le gaz est présent. Alors le gaz obtient le volume du conteneur. La densité d'un gaz est très inférieure à celle des solides et des liquides.
Qu'est-ce que la théorie moléculaire cinétique?
La théorie moléculaire cinétique est une théorie qui décrit les propriétés physiques des gaz à leur niveau moléculaire. Les concepts de la théorie moléculaire cinétique sont les suivants.
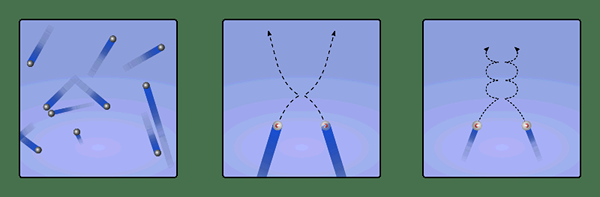
- Les gaz contiennent des particules en mouvement constant et aléatoire.
- Ces particules entrent en collision les unes avec les autres. Les collisions sont complètement élastiques.
- Le volume d'une molécule de gaz est négligeable par rapport au volume du récipient dans lequel le gaz est présent. Mais ces particules ont une masse considérable.
- Il n'y a pas de forces intermoléculaires entre les molécules de gaz.
- L'énergie cinétique moyenne du gaz est proportionnelle à la température absolue du gaz.

Figure 2: Collisions pures entre les particules de gaz
La relation entre l'énergie cinétique et la vitesse des molécules de gaz peut être donnée comme ci-dessous.
Ke = ½.mv2
Où ke est l'énergie cinétique, m est la masse d'une particule de gaz et V est la vitesse moyenne des molécules de gaz. Mais la mesure de ces paramètres est difficile; Ainsi, l'équation est modifiée comme ci-dessous.
Ke = 3/2.kBT
Où ke est l'énergie cinétique, kB est la constante de Boltzmann (1.381 × 10-23 m2 kg s-2 K-1), et t est la température absolue du gaz (en unités Kelvin). Cette équation indique que l'énergie cinétique du gaz est directement proportionnelle à la température absolue du gaz.
Quelle est la différence entre le modèle de particules de la matière et la théorie moléculaire cinétique?
Modèle de particules de la matière vs théorie moléculaire cinétique | |
| Le modèle de matière de particules est un modèle qui explique la disposition des particules (atomes, molécules ou ions) dans une certaine phase de matière. | La théorie moléculaire cinétique est une théorie qui indique les propriétés physiques des gaz à leur niveau moléculaire. |
| Composants | |
| Le modèle de particules de matière décrit les propriétés des phases solides, liquides et gazeuses de la matière. | La théorie moléculaire cinétique décrit les propriétés des gaz. |
| Contenu | |
| Le modèle de la matière explique la disposition des particules dans un solide, un liquide ou un gaz. | La théorie moléculaire cinétique explique la relation entre l'énergie cinétique et d'autres propriétés d'un gaz. |
Résumé - Modèle de particules de matière vs théorie moléculaire cinétique
Le modèle de particules et la théorie moléculaire cinétique expliquent différentes propriétés physiques de la matière. Le modèle de particules est le modèle qui explique la disposition des particules (atomes, molécules ou ions) dans une certaine phase de matière. La théorie moléculaire cinétique décrit la relation entre l'énergie cinétique et d'autres propriétés d'un gaz. La principale différence entre le modèle de particules de matière et la théorie moléculaire cinétique est que le modèle de particules de matière décrit les propriétés des phases solides, liquides et gazeuses de la matière tandis que la théorie moléculaire cinétique décrit les propriétés des gaz.
Référence:
1. «Modèle de particules de solides, de liquides et de gaz.»Chemstuff, 8 juin 2012, disponible ici.
2. Baker, Rhys. «Quel est le modèle de particules - un guide des solides, des liquides et des gaz.»Owlcation, Owlcation, 14 juin 2016, disponible ici.
3. LibreTexts. «Théorie moléculaire cinétique des gaz.”Chemistry LibreTexts, LibreTexts, 2 octobre. 2016, disponible ici.
Image gracieuseté:
1. «States of Matter en» de Yelod - Wikimedia Commons * Yelod - Wikipedia (en) * ילוד - ויקיפדיה העברית - propre travail, (CC By-Sa 3.0) via Commons Wikimedia
2. «Théorie cinétique des gaz (2)» par Olivier Cleynen et utilisateur: Sharayanan - propre travail basé sur le dossier: théorie cinétique des gaz.SVG (CC BY-SA 3.0) via Commons Wikimedia


