Différence entre l'hémoglobine oxygénée et désoxygénée
Différence clé - oxygéné vs hémoglobine désoxygénée
L'hémoglobine est une protéine trouvée dans les globules rouges, qui transportent l'oxygène des poumons aux tissus corporels et aux organes et au dioxyde de carbone des tissus et des organes corporels aux poumons. Il y a deux états d'hémoglobine: l'hémoglobine oxygénée et désoxygénée. La principale différence entre l'hémoglobine oxygénée et désoxygénée est que L'hémoglobine oxygénée est l'état d'hémoglobine lié à quatre molécules d'oxygène tandis que l'hémoglobine désoxygénée est l'état non lié de l'hémoglobine avec de l'oxygène. L'hémoglobine oxygénée est de couleur rouge vif tandis que l'hémoglobine désoxygénée en rouge foncé.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hémoglobine
3. Qu'est-ce que l'hémoglobine oxygénée
4. Qu'est-ce que l'hémoglobine désoxygénée
4. Comparaison côte à côte - hémoglobine oxygénée vs désoxygénée
5. Résumé
Qu'est-ce que l'hémoglobine?
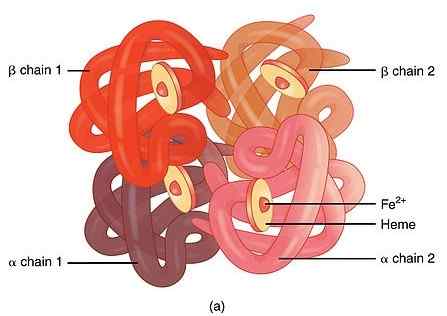
L'hémoglobine (HB) est une molécule de protéine complexe présente dans les globules rouges qui donne la forme typique des globules rouges (rond avec un centre étroit). Les rôles clés de l'Hb comprennent le transport de l'oxygène des poumons aux tissus corporels, l'échanger avec du dioxyde de carbone et la prise de dioxyde de carbone des tissus corporels vers le poumon et l'échange avec de l'oxygène. La molécule d'hémoglobine contient quatre chaînes polypeptidiques (sous-unités protéiques) et quatre groupes hématiques comme le montre la figure 01. Quatre chaînes de polypeptides représentent deux chaînes alpha globulines et deux chaînes bêta globulines. L'hème est un composé de porphyrine important dans la molécule d'hémoglobine qui a un atome de fer central intégré à l'intérieur. Chaque chaîne polypeptidique de la molécule d'hémoglobine contient un groupe d'hème et un atome de fer. L'atome de fer est vital pour le transport de l'oxygène et du dioxyde de carbone dans le sang et c'est le principal contributeur de la couleur rouge des globules rouges. L'hémoglobine est également appelée méttaloprotéine En raison de son incorporation d'atomes de fer.
L'approvisionnement en oxygène aux tissus et aux organes est vital et essentiel. Les cellules obtiennent de l'énergie par la respiration aérobie (phosphorylation oxydative) en utilisant l'oxygène comme accepteur d'électrons. La production d'énergie est nécessaire pour un métabolisme et des fonctions optimales. L'offre d'oxygène est facilitée par les protéines d'hémoglobine. Par conséquent, l'hémoglobine est également connue sous le nom d'oxygène portant des protéines dans le sang.
Le faible niveau d'hémoglobine dans le sang appelé anémie. La condition d'anémie peut provoquer plusieurs maladies. Il existe différentes raisons pour les faibles concentrations d'hémoglobine dans le sang. La carence en fer est la principale raison, tandis que un régime excessif, des modes de vie malsains, certaines maladies et cancers sont également des causes pour les mêmes.
La molécule d'hémoglobine a quatre sites de liaison à l'oxygène associés à quatre Fe+2 atomes. Une molécule d'hémoglobine peut transporter un maximum de quatre molécules d'oxygène. Par conséquent, l'hémoglobine peut être saturée ou insaturée d'oxygène. La saturation en oxygène est le pourcentage de sites de liaison à l'oxygène d'hémoglobine occupées par l'oxygène. En d'autres termes, il mesure la fraction de l'hémoglobine saturée en oxygène par rapport à l'hémoglobine totale. Ces deux états de l'hémoglobine sont appelés hémoglobine oxygénée et désoxygénée.
Figure 1: Structure de l'hémoglobine
Qu'est-ce que l'hémoglobine oxygénée?
Lorsque les molécules d'hémoglobine sont liées et saturées de molécules d'oxygène, la combinaison de l'hémoglobine avec de l'oxygène est connue sous le nom d'hémoglobine oxygénée (oxyhémoglobine). L'hémoglobine oxygénée se forme pendant la respiration physiologique (ventilation), lorsque les molécules d'oxygène se lient aux groupes hématiques de l'hémoglobine dans les globules rouges. La production d'hémoglobine oxygénée se produit principalement dans les capillaires pulmonaires proches des alvéoles des poumons où l'échange gazeux se produit (inhalation et exhalation). L'affinité de la liaison à l'oxygène à l'hémoglobine est fortement influencée par le pH. Lorsque le pH est élevé, il y a une forte affinité de la liaison à l'oxygène à l'hémoglobine mais elle diminue à mesure que le pH diminue. Il y a normalement un pH élevé dans les poumons et un pH bas dans les muscles. Ainsi, cette différence dans les conditions de pH est utile pour la fixation, le transport et la libération d'oxygène. Puisqu'il y a une affinité de liaison élevée près du poumon, l'oxygène se lie à l'hémoglobine et fait de l'oxyhémoglobine. Lorsque l'oxyhémoglobine atteint le muscle en raison d'un pH faible, il se dissout et libère de l'oxygène aux cellules. Le niveau normal d'oxygène dans le sang de l'homme est considéré comme dans la plage de 95 à 100%. Le sang oxygéné est visible dans la couleur rouge vif (rouge cramoisi). Lorsque l'hémoglobine est sous forme oxygénée, elle est également connue sous le nom d'état R (état détendu) de l'hémoglobine.
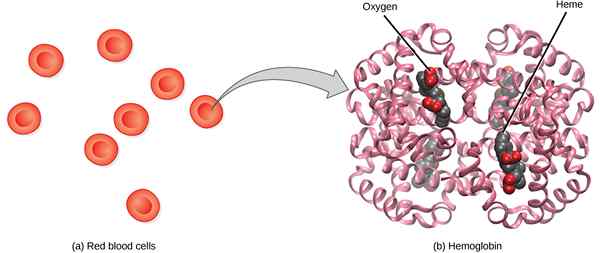
Figure 2: hémoglobine oxygénée
Qu'est-ce que l'hémoglobine désoxygénée?
L'hémoglobine désoxygénée est la forme d'hémoglobine qui n'est pas liée à l'oxygène. L'hémoglobine désoxygénée manque d'oxygène. D'où cet état appelé T l'état (état tendu) de l'hémoglobine. L'hémoglobine désoxygénée peut être observée lorsque l'hémoglobine oxygénée libère l'oxygène et qu'elle est échangée avec du dioxyde de carbone près de la membrane plasmique des cellules musculaires où il y a un environnement à pH faible. Lorsque l'hémoglobine a une faible affinité vers la liaison à l'oxygène, il délivre de l'oxygène et se converti en hémoglobine désoxygénée.
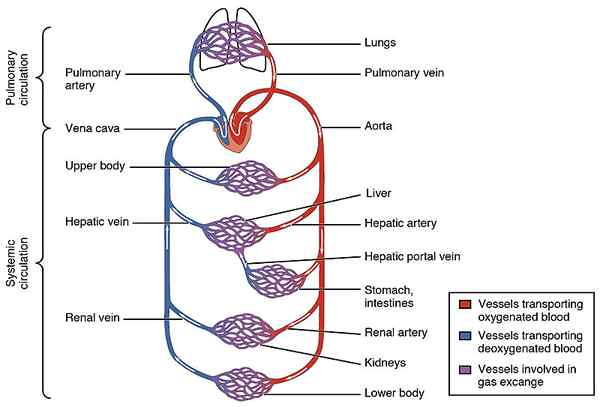
Figure 3: flux sanguin oxygéné et désoxygéné à travers le corps
Quelle est la différence entre l'hémoglobine oxygénée et désoxygénée?
Oxygéné vs hémoglobine désoxygénée | |
| L'hémoglobine oxygénée est la combinaison de l'hémoglobine plus de l'oxygène. | La forme non liée d'hémoglobine avec de l'oxygène est connue sous le nom d'hémoglobine désoxygénée. |
| État de molécule d'oxygène | |
| Les molécules d'oxygène sont liées à la molécule d'hémoglobine. | Les molécules d'oxygène ne sont pas liées à la molécule d'hémoglobine. |
| Couleur | |
| L'hémoglobine oxygénée est de couleur rouge vif. | L'hémoglobine désoxygénée est de couleur rouge foncé. |
| État d'hémoglobine | |
| Ceci est connu comme le R État de l'hémoglobine. | Ceci est connu comme le T (tendu) état de l'hémoglobine. |
| Formation | |
| L'hémoglobine oxygénée est formée lorsque les molécules d'oxygène se lient aux groupes hématiques de l'hémoglobine dans les globules rouges pendant la respiration physiologique. | L'hémoglobine désoxygénée est formée lorsque l'oxygène est libéré de l'hémoglobine oxygénée et est échangé avec du dioxyde de carbone près de la membrane plasmique des cellules musculaires. |
Résumé - hémoglobine oxygénée et désoxygénée
L'hémoglobine est une protéine vitale trouvée dans les globules rouges qui est capable de transporter de l'oxygène du poumon aux tissus corporels et d'apporter du dioxyde de carbone des tissus corporels dans le poumon. Il y a deux états d'hémoglobine en raison de la liaison de l'oxygène. Ce sont de l'hémoglobine oxygénée et de l'hémoglobine désoxygénée. L'hémoglobine oxygénée se forme lorsque les molécules d'oxygène attachées aux atomes Fe. L'hémoglobine désoxygénée est formée lorsque les molécules d'oxygène sont libérées de la molécule d'hémoglobine. C'est la principale différence entre l'hémoglobine oxygénée et désoxygénée. La fixation et la libération d'oxygène sont principalement influencées par le pH et la pression partielle de l'oxygène.
Référence:
1. Thomas, Caroline et Andrew B. Se baisser. «Physiologie de l'hémoglobine.»Physiologie de l'hémoglobine | Éducation BJA | Oxford Academic. Oxford University Press, 15 mai 2012. la toile. 20 février. 2017.
2. Marengo-Rowe, Alain J. «Relations de structure-fonction des hémoglobines humaines.»Procédure (Université de Baylor. Centre médical). Système de soins de santé de Baylor, juillet 2006. la toile. 20 février. 2017
Image gracieuseté:
1. «1904 Hemoglobin» par OpenStax College - Anatomy & Physiology, Connexions Web Site Web. (CC par 3.0) via Commons Wikimedia
2. «Figure 39 04 01» par CNX OpenStax - (CC par 4.0) via Commons Wikimedia
3. 2101 Blood Flow à travers le cœur »par OpenStax College - Anatomy & Physiology, Connexions Web Site. (CC par 3.0) via Commons Wikimedia


